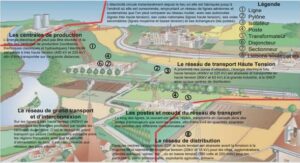
Effet de la géométrie de la surface d’attache sur la croissance des biofilms, tutoriel & guide de travaux pratiques en pdf.
Effet de la hauteur du microcanal sur la croissance à partir des côtés étudié par microscopie en champ clair
Les forces de cisaillement ainsi que la vélocité du flux sont déterminantes pour les différentes étapes de croissance. Afin de conserver les forces de cisaillement constantes, deux microcanaux de hauteurs différentes ont été utilisés et les débits ont été ajustés. Les forces de cisaillement ont un impact important sur la croissance des biofilms puisqu’ils en provoquent l’érosion [8]. Les microcanaux ont la même longueur et la même largeur, mais ils ont une hauteur différente. Ils mesurent respectivement 88 et 145 µm de haut et leur largeur est de 2000 µm. L’équation 3-5 a été utilisée afin de calculer le débit pour lequel les forces de cisaillement sont identiques et l’équation 3-4 permet de calculer la vélocité moyenne dans ces deux canaux. Le Tableau 5-1 présente les vitesses moyennes et les forces de cisaillement moyennes pour les deux dispositifs ainsi que les débits appliqués. Afin que les forces de cisaillement moyennes soient identiques dans les deux microcanaux, un débit 2,7 fois plus élevé pour le dispositif d’une hauteur de 145 µm a été utilisé. Dans cette situation, la vitesse moyenne est 1,65 fois plus élevée pour ce canal.
Tableau 5-1 : Vitesse moyenne ( ), force de cisaillement moyenne ( ) pour les canaux deux dispositifs utilisés et les débits du milieu de culture.
Les mesures de microscopie en champ clair sont optimisées afin de faire plusieurs mesures sur différents canaux en parallèle. Ainsi pour chaque expérience, il est possible de faire des mesures sur quatre microcanaux en même temps. Cela permet de faire simultanément deux réplicas pour chaque hauteur de microcanal utilisé. Les mesures en parallèle comportent deux avantages importants. Le premier est qu’en faisant les mesures en parallèle, il est possible de s’assurer que les mesures soient faites exactement dans les mêmes conditions puisqu’on peut utiliser la même solution de bactéries pour l’inoculation. Ce faisant, on élimine ce facteur d’incertitude dans les mesures. Le second est que cela permet de réduire le temps total pour faire les différents réplicas et d’optimiser l’utilisation du microscope. Tel que décrit dans la section expérimentale (Chapitre 3), l’acquisition des micrographies est automatisée et une platine motorisée permet le positionnement précis de chaque microcanal sous le microscope. De cette manière, chaque micrographie pour un même canal est prise au même endroit que la précédente facilitant ainsi le traitement des données. Dans ce cas, il n’est pas nécessaire de procéder à l’alignement des micrographies lors du traitement de données. Afin de pouvoir faire des mesures quantitatives et de convertir les micrographies pour déterminer la densité optique pour chaque pixel, il faut procéder à la soustraction d’une image de référence.
La Figure 5-2 montre les images de densité optique d’un biofilm pendant la croissance dans un microcanal d’une hauteur de 88 µm. Pour ces mesures, les biofilms de Pseudomonas sp. CT07 ont été inoculés de manière directe tel que décrit dans la section expérimentale. Au début de l’expérience aucun biofilm n’est observé, puis après 45 heures, une faible biomasse commence à apparaître sur les deux côtés du microcanal. Il y a augmentation rapide du contraste à cet endroit et propagation vers le centre du canal. Après 70 heures, le biofilm est uniforme et a une densité optique élevée sur les côtés du microcanal. Il est hétérogène et de faible biomasse au centre du microcanal. Les microcolonies qui y sont observées sont indépendantes les unes des autres et leur taille est de l’ordre de la dizaine de microns. Ces résultats correspondent bien aux structures observées pour les biofilms dans un milieu AB (voir chapitre 6) et dans un milieu de culture minimal [104]. Deux lignes noires sont observées là où se trouvent les murs du microcanal. À cet endroit, la présence de ces structures élevées provoque la formation d’une ombre qui masque partiellement les bords du microcanal. Sur une région d’environ 20 µm à partir du bord du microcanal, cette ombre a un impact sur les mesures de densité optique et les rend plus imprécises ce qui pourrait affecter les résultats et conclusion qui en sont tirés. Toutes les données prises à partir de ces images sont faites à partir de 40 µm du mur du microcanal afin d’éviter cet effet. De plus, les micrographies en microscopie en champ clair représentent la densité optique dans toute la hauteur du microcanal. Les biofilms doivent être attachés à une surface pour croître. Les résultats obtenus proviennent donc à la fois des parties de biofilm attachées au mur du fond et du mur du haut du microcanal.
Figure 5-2 : Images de densité optique obtenues à partir de mesures en microscopie en champ clair d’un biofilm de Pseudomonas sp. CT07 après croissance dans un microcanal d’une profondeur de 88 µm pendant A) 15, B) 45, C) 55 et D) 70 heures. Un milieu de culture AB modifié est utilisé et l’écoulement se fait de la gauche vers la droite dans le microcanal. La barre d’échelle en A) mesure 500 µm et est représentative pour toutes les images.
Afin de mieux suivre la croissance, la densité optique a été mesurée à chaque intervalle de 20 µm dans la section transversale du microcanal. La Figure 5-3 montre les résultats pour le microcanal d’une hauteur de 88 µm à différentes distances du mur. À proximité du mur (40 µm), la densité optique est constante et près de zéro jusqu’à environ 40 heures, ce qui correspond à la période de latence du biofilm. Entre 40 et 60 heures, la densité optique augmente jusqu’à 2,75. Cette partie correspond à la période de croissance rapide. Par la suite, la densité optique demeure élevée et relativement constante jusqu’à la fin de la période d’observation. À des distances plus grandes du mur de côté, la période de latence est plus longue. Par exemple, à une distance de 200 µm, elle est d’environ 45 heures. La pente de la région de croissance rapide est aussi plus faible. Au centre du microcanal la période de latence est de 60 heures et la pente de la phase de croissance rapide est très faible. Pour les distances intermédiaires, la transition se fait graduellement.
Figure 5-3 : Courbe de croissance d’un biofilm de Pseudomonas sp. CT07 à 40, 100, 200, 300, 400 et 500 µm du mur du microcanal d’une hauteur de 88 µm (respectivement en noir, gris, orange, rouge, bleu et vert). Les courbes de croissance sont générées à partir de la densité optique obtenue après le traitement des images en microscopie en champ clair. La ligne pointillée pour la courbe noire montre la région utilisée pour les mesures de taux de croissance dans la phase de croissance rapide du biofilm.
Figure 5-4 : Taux d’augmentation de la densité optique dans la phase de croissance rapide du biofilm pour différentes distances à partir du mur du microcanal. Les données pour des canaux de 88 et 145 µm sont représentées respectivement en bleu et orange. Les résultats pour les deux mesures correspondent à la moyenne de trois réplicas et les barres d’erreur à leur écart type.
Le taux de croissance des biofilms a été mesuré dans la phase de croissance rapide.
Le biofilm au centre n’atteint pas de phase stationnaire, donc il n’est possible de mesurer le temps de doublement. Pour ce faire, une droite a été ajustée sur cette section de la courbe de densité optique en fonction du temps tel qu’illustré par la ligne pointillée à la Figure 5-3. Cette opération fut répétée pour chaque courbe de densité optique pour les deux dispositifs. Les taux d’augmentation de la densité optique dans la phase de croissance rapide pour les deux dispositifs se trouvent à la Figure 5-4. Ce graphique a été généré en calculant la moyenne de trois différentes séries de données acquises dans les mêmes conditions pour les deux dispositifs et 96 les barres d’erreur correspondent à l’écart type sur ces mesures. Dans les deux cas, la croissance est plus rapide à proximité des murs. La zone où la croissance est la plus rapide est aussi plus large pour le canal de hauteur plus grande. À partir d’environ 360 µm du mur, le taux d’augmentation de la densité optique est le même dans les deux cas. L’écart type sur les mesures est aussi plus élevé à proximité du mur, ce qui indique une plus grande variabilité dans le taux de croissance à cet endroit comparativement à celui mesuré au centre du microcanal. Dans le cadre de ces expériences, le débit a été ajusté afin que les forces de cisaillement soient constantes. D’après l’équation 2-4, lorsque l’on augmente la hauteur du microcanal de 1,64 fois, comme dans le cas présent, il faut augmenter le débit d’un facteur 2,72 pour compenser.
Il y a un gradient de vélocité entre les murs et le centre d’un milieu d’un microcanal. Cela provoque un cisaillement entre les différentes couches de l’écoulement laminaire et entre l’écoulement et une surface qui s’y trouve. Les forces de cisaillement sont plus importantes sur les murs et diminuent graduellement lorsqu’on se rapproche du centre du microcanal (Figure 2-1). Un cas particulier est observé pour les forces de cisaillement directement au-dessus d’un mur. Elles sont maximales au milieu de ce mur et diminuent jusqu’à être nulles lorsque les deux murs se rejoignent, donc au coin [8]. Cela peut donc favoriser la croissance initiale dans le coin puisque c’est à cet endroit que les forces de cisaillement sont les plus faibles dans le canal. Pour ce qui est du taux de croissance plus élevé pour le canal plus haut, cela pourrait s’expliquer par une quantité de nutriments plus importante. En effet, à un débit plus élevé, la solution nutritive (milieu de culture) est renouvelée plus rapidement et le flux moléculaire dans le biofilm est plus grand. Par conséquent, il y a plus de nutriments disponibles pour les bactéries et le biofilm. De plus, l’élimination des déchets est favorisée. D’un autre côté, puisque les forces de cisaillement sont les mêmes, l’érosion du biofilm devrait être similaire pour les deux microcanaux [8]. C’est principalement cette force qui peut provoquer le détachement des bactéries ou de parties du biofilm dans des conditions d’écoulement laminaire. Il a déjà été rapporté que pour des microcanaux de mêmes dimensions, une augmentation du débit diminue significativement le taux de croissance et peut même empêcher la formation d’un biofilm stable. Un débit trop important pourrait nuire à, voire même interrompre, la communication entre des cellules dans la direction opposée à l’écoulement [115]. Il a aussi été observé dans d’autres travaux que l’apport de nutriments est un facteur plus déterminant que les forces de cisaillement pour la croissance des biofilms [59].
Si on considère le biofilm comme étant complètement homogène et lisse, une augmentation du débit, lorsqu’il est déjà suffisamment élevé, devrait avoir un impact relativement faible sur l’apport de nutriments. Le mélange dans un écoulement laminaire se fait seulement par diffusion contrairement aux écoulements turbulents où il y a convection. Le facteur limitant est donc la vitesse de diffusion à travers le biofilm qui est lente et dépend de sa forme, de sa densité et de de sa composition [59]. Il est important de considérer que les biofilms ont tendance à former différentes structures favorisant la circulation de liquide au sein du biofilm afin de contrer la barrière de diffusion et éviter la formation de gradients de concentration trop élevés [9]. Par exemple, les structures en forme de champignon ont une base plus étroite que la partie du haut ce qui favorise l’écoulement entre les différentes parties du biofilm et rend les nutriments plus disponibles pour les bactéries qui sont à l’intérieur [116].
Les micrographies du biofilm à la Figure 5-2 permettent de voir qu’il forme des petites structures (de taille autour de 10 µm) au centre et des structures plus hautes et homogènes sur les côtés. La microscopie en champ clair avec un objectif à faible magnification ne permet pas de les caractériser précisément puisque la résolution et le contraste sont trop faibles. Puisque cette technique est basée sur la transmission de la lumière, il n’est pas possible la base du biofilm des parties supérieures. La microscopie confocale est un bon moyen pour mieux comprendre la croissance du biofilm à partir des côtés.