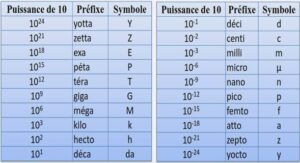
Aperçu théorique des phénomènes intervenant en précipitation
La cristallisation et la précipitation ont des aspects communs dès lors qu’il s’agit pour l’une comme pour l’autre de provoquer l’apparition d’un solide à partir d’une solution. S’il fallait les distinguer, on pourrait définir :La précipitation pourrait être considérée comme le résultat d’une réaction chimique entre deux solutions réactives ou par relargage (addition de tiers corps), avec apparition d’un produit insoluble. Cette opération, généralement irréversible, est extrêmement rapide puisqu’elle a lieu à des fortes sursaturations.La solubilité est utilisée pour désigner la quantité maximale de soluté qu’on peut dissoudre dans une quantité donnée de solvant pour une température et une pression donnée. Elle est en général une fonction croissante et très sensible de la température. Elle s’exprime en mole de soluté par unité de volume de solution ou en kg de soluté par kg de solution par exemple.
Saturation et sursaturation
La saturation Une solution est saturée en soluté à température et pression données lorsque sa concentration atteint la valeur maximale C∗ de « solubilité ». La concentration C∗ est liée à la température par l’équation 1.1, où ∆Hd représente l’enthalpie de dissolution.dans les même conditions de température et de pression ; cet écart induit la force motrice de la précipitation ou de la cristallisation. Elle gouverne les différents processus de germination et de croissance et conditionne la pureté, la morphologie et la taille des cristaux. La force motrice (∆µi) de la précipitation est donnée par l’écart entre le potentiel chimique de la solution à l’état sursaturé (µsursaturée), et celui de la solution à l’état saturé (µsaturée) :Le passage de l’état sursaturé à l’état saturé a lieu spontanément tant que ∆G < 0, et tend à un état d’équilibre lorsque ∆G = 0. On distingue trois formules de définition de la sursa- turation : la sursaturation absolue (éq. 1.3), la sursaturation relative (éq. 1.4) et le rapport de sursaturation (éq. 1.5). Pour un électrolyte de type AxBy ⇋ xAαDe nombreux ouvrages (livres ou thèses de doctorat) décrivent en détail les différents phé- nomènes intervenant lors d’une précipitation. Nous nous contenterons dans ce manuscrit de rappeler brièvement ceux-ci.
Germination
La germination ou la nucléation est l’étape par laquelle une phase solide apparaît sous forme de germes qui constituent les embryons des futurs cristaux. C’est l’étape la plus difficile à appréhender et à observer, mais elle est primordiale car elle détermine : le nombre de grains préparés, la taille, le faciès, la pureté, le polymorphisme, etc. La figure 1.1 montre qu’on peut classer les processus de germination en deux grandes catégories : germination primaire et germination secondaire.Dans le cas de la germination primaire, les germes apparaissent dans un milieu libre de cristaux. Cette germination est homogène si les germes se forme dans le volume même de la solution. Elle est hétérogène si les germes apparaissent sur la surface d’une phase solide de nature physique ou chimique différente de celle du cristal.
Germination primaire homogène Dans une solution sursaturée, il existe des molécules isolées et des embryons formés de plusieurs molécules. L’embryon atteint une taille suffisante pour être considéré comme un germe cristallin. La naissance des germes, implique à la fois la création d’un volume et d’une surface, ce qui met en jeu deux énergies antagonistes dont la résultante est l’énergie libre de germination ∆G. Si on suppose le germe parfaitement sphérique de rayon r, l’énergie libre s’écrit :Germination primaire hétérogène Le processus de germination primaire hétérogène est identique à celui de la germination primaire homogène, à la différence près que les germes naissent préférentiellement sur la surface d’un substrat : parois, agitateur, chicanes, impure- tés . . . plutôt que dans la solution mère homogène. Le mécanisme de la germination primaire hétérogène est contrôlée par l’angle de mouillage θ.
La germination secondaire se produit dans une solution de très faible sursaturation. En effet, ce sont les cristaux ensemencés ou déjà formés qui en génèrent de nouveaux. Les sources majeures de cette germination sont multiples, on distingue :La germination secondaire vraie due au détachement d’excroissances dendritiques ou d’une certaine rugosité ou d’embrayons présents dans une couche adjacente à la surface par le cisaillement du liquide en mouvement. Ces fragments ne grandissent que si elles sont supé- rieures à la taille critique r∗.La germination secondaire est un phénomène complexe et peu connu. Une théorie générale prédisant la vitesse de germination n’existe pas encore. Malgré cela, dans la pratique, Van Der Heijden et al. (1994) proposent une loi semi-empirique pour décrire la cinétique de germination secondaire [Heijden-1994].