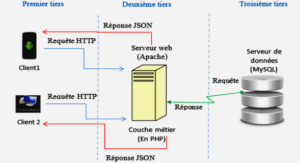
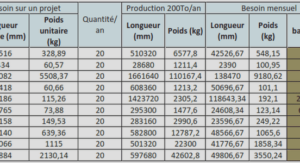
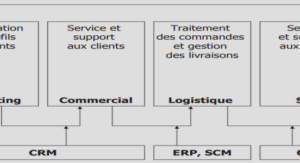
Complexation des métaux par les colloïdes naturels et ligands organiques dissous dans les estuaires
Dans le milieu aquatique, de nombreuses interactions ont lieu entre différents composés organiques et inorganiques. Ces interactions ne sont pas bien caractérisées et souvent très peu connues. Pour faciliter l’étude des eaux naturelles, les géochimistes ont été amenés à séparer ces composés en groupes ayant certaines propriétés communes. Lors de l’étude de la spéciation des métaux dans les milieux estuariens et marins, la classification la plus commune est basée sur la distinction entre les particules en suspension et les composés dissous. En général, la séparation entre phase particulaire et phase dissoute se fait par filtration utilisant des filtres de 0 4um ou 0.45um de porosité Le filtrat est alors un mélange de composés vraiment dissous (ions libres et molecules de faible poids moléculaire), de composés organiques dissous ou colloïdaux (virus, bactéries, protéines, peptides, polysaccharides,…) et de colloïdes inorganiques (alurninosiiîcates, oxydes et hydroxydes de métaux,…) souvent appelés colloïdes. Le rôle des colloïdes et des composés organiques dissous dans les échanges solide/liquide des métaux dans le milieu aquatique est mal étudié (Wells et Goldberg, 1992). La composition des colloïdes et des ligands organiques dissous est presque inconnue (sauf quelques études spécifiques), et leur caractérisation s’avère nécessaire (Sigleo et al., 1982; Sempere, 1991) Les colloïdes et ligands organiques dissous contribuent à la fixation des métaux dans les milieux estuariens et marins et peuvent contrôler la partition de métaux entre les phases dissoutes et particulaires (Morel et Gschwend, 1987). Baskaran et al. (1992) et Baskaran et Santschi (1993) ont montré qu’il y »a une cohérence entre la réactivité des colloïdes naturels et celle des particules détectées par filtration vis-à-vis de Pb, Be et Th.
Ce chapitre est consacré à l’étude de la complexation des métaux par les colloïdes et les ligands organiques dissous estuariens. Une méthode simple a été développée servant à quantifier le pouvoir complexant de ces composés non détectables par filtration et à donner une spéciation des métaux entre les phases vraiment dissoute, colloïdale ou organique dissoute et particulate. La méthode consiste à ajouter à une solution d’eau naturelle un ligand dissous puissant (EDTA) en faibles quantités. Dans le cas de présence d’une grande quantité de colloïdes et ligands dissous suffisamment réactifs vis-à-vis des métaux, l’ajout d’un peu d »EDTA n’a aucun effet sur les FDC Au contraire, dans le cas d’absence de colloïdes et de ligands dissous les métaux sont complexés par l’EDTA dans la phase dissoute et les FDC baissent en fonction de la quantité d’EDTA ajoutée. En général on est situé dans un état intermédiaire, il est alors possible d’estimer l’intensité de complexation du filtrat par la différence entre la décroissance des FDC mesurés en fonction de la quantité d’EDTA ajoutée avec la décroissance théorique des FDC dans le cas d’absence de ligands dissous et de colloïdes (Schémas 1). Nous supposons que les complexes d’EDTA ne s’adsorbent pas à la surface des particules. La validité de cette hypothèse est discutée plus loin dans ce chapitre.La méthode utilisée soulève trois problèmes. Le premier est ce que les réactions des métaux avec l’EDTA sont suffisamment rapides (temps de réaction < 4h) pour avoir des mesures fiables de FDC? Le second est le masquage de l’effet de l’EDTA par la complexation des métaux (spécialement Cd) par les anions majeurs d’eau de mer. Ces deux problèmes sont étudiés plus loin dans ce chapitre. Le troisième problème est que la concentration naturelle d’EDTA dans les eaux estuariennes est non négligeable. Dans ce cas faute de mesures. l’EDTA naturelle fait partie de la quantité de ligands dissous ou colloïdal total et inconnu L.L’ajout d’EDTA aux échantillons naturels marqués entraîne la complexation des radionuclides réduisant ainsi leurs adsorption à la surface des particules en suspension. Ceci est vrai seulement si les complexes de métaux avec l’EDTA ne se fixent pas à la surface des particules. Bowers et Huang (1986), Sunda (1984) et Osaki et al. (1990) ont montré qu’à pH 8, {‘adsorption de complexes de métaux avec l’EDTA sur les particules solides (respectivement sur des particules d’alumine, une résine échangeuse d’ions « chelex » et du cilicagel) est négligeable. Donc l’ajout d’EDTA aux échantillons marqués entraînera une réduction des FDC des métaux qui réagissent avec l’EDTA (dans 4 heures de temps de réaction).