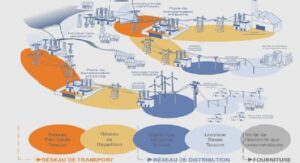
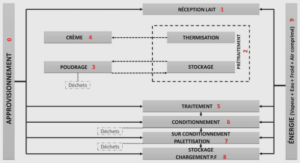
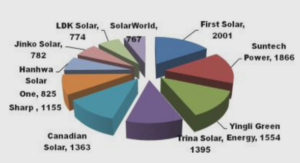
Définition et description de la DM1
En 1909, Leipzig Steinert a décrit pour la première fois une maladie neuromusculaire qu’il nomma la maladie de Steinert (Steinberg and Wagner 2008). Aujourd’hui, cette maladie est principalement connue sous le nom de dystrophie myotonique de type 1 (DM1), toutefois elle peut aussi être citée dans les écrits sous Dystrophia Myotonica ou Myotonica Atrophica (Woodward, Heaton et al., 1982). Le terme myotonie est utilisé pour définir la rigidité musculaire observée en raison du délai de la relaxation musculaire après la contraction initiale (potentiel d’actions répétitives), alors que la dystrophie est le nom donné aux troubles musculaires caractérisés par un affaiblissement et la présence de dégénérescence (perte musculaire). La DM1 est classée comme un trouble de répétition trinucléotidique causé par une expansion anormale de triplets dans la séquence de l’ADN (Musova, Mazanec et al., 2009). Dans ce cas, la mutation sous-jacente de la DM1 est une expansion répétée du (CTG) n dans la région 3′ non traduite du gène de la protéine kinase de Dystrophia Myotonica (DMPK) sur le chromosome 19q13.3 (Fu, Pizzuti et al. 1992, Frisch, Singleton et al., 2001, Cho and Tapscott 2007). L’expansion des répétitions CTG dans la DMPK entraîne : (1) premièrement, une rétention intranucléaire et une accumulation des transcrits de la DMPK mutants contenant une répétition CUG élargie (2) entraînant ensuite des modifications du traitement de l’ARN dans de multiples gènes en aval et (3) causant ainsi une diminution des niveaux de protéine DMPK (Krahe, Ashizawa et al., 1995, Philips, Timchenko et al., 1998, Miller, Urbinati et al., 2000, Mankodi, Urbinati et al., 2001, Kaliman et Llagostera, 2008; Llamusi et Artero 2008, Franc, Muetzel et al., 2012).
Les individus atteints de DM1 peuvent présenter l’un des cinq phénotypes allant en ordre de gravité décroissante : la forme congénitale, la forme infantile, la forme juvénile, la forme adulte et la forme légère (De Antonio, Dogan et al., 2016, Gagnon, Petitclerc et al., 2018). Les différences phénotypiques se chevauchent quelque peu et elles sont principalement définies en fonction de l’âge d’apparition des symptômes et des caractéristiques cliniques, entre autres, le nombre de répétitions CTG. Parmi les différentes populations dans le monde, le triplet CTG compte entre 5 et 31 copies (Zerylnick, Torroni et al., 1995). La DM1 est caractérisée par une grande variabilité clinique intrafamiliale et interfamiliale avec des répétitions de CTG allant de 50 à plus de 4 000 répétitions (Kumar, Agarwal et al., 2013). Selon certaines études, le nombre de répétitions de CTG est en corrélation avec l’âge d’apparition des symptômes et la gravité de la maladie (Harley, Rundle et al., 1993, Redman, Fenwick et al., 1993, Melacini, Villanova et al., 1995, Bachmann, Damian et al., 1996, Savić Pavićević, Miladinović et al., 2013). Les personnes atteintes par la forme adulte de DM1 possèdent 100 à 1 000 répétitions de CTG et l’âge d’apparition des symptômes est estimé généralement entre 20 et 30 ans (IDMC 2000).
Dans la DM1, l’instabilité intergénérationnelle de la méiose peut être considérable et un phénomène d’anticipation fait que la maladie se manifeste plus tôt ou s’aggrave de plus en plus dans les générations suivantes (Höweler, Busch et al., 1989, RakocevicStojanovic, Savic et al., 2005, Schara and Schoser 2006, Martorell, Cobo et al., 2007, Hilton-Jones 2012). Néanmoins, une contraction des répétitions CTG ou une transmission stable des allèles a également été enregistrée dans de rares cas, se produisant exclusivement dans des transmissions paternelles (Ashizama, Anvret et al., 1994, Salehi, Bonifazi et al., 2007, Musova, Mazanec et al., 2009). La transmission génétique de la DM1, maladie autosomique dominante, suit la loi de Mendel qui prédit un taux de transmission de 50% (Martorell, Cobo et al., 2007, Laird and Lange 2011). Cependant, la transmission parentale influence l’expansion de la répétition de CTG, la transmission intergénérationnelle paternelle étant minimale (moyenne=56 CTG, SD=177 CTG), alors que la transmission maternelle est très élevée (moyenne=948 CTG, SD=815 CTG) (Harley, Rundle et al., 1993, Martorell, Cobo et al., 2007).
La prédiction du phénotype basée uniquement sur la taille de la répétition CTG reste très difficile, à l’exception des phénotypes situés aux extrémités (Machuca-Tzili, Brook et al., 2005). Pour les personnes atteintes de DM1, il est improbable d’établir un pronostic précis ou de prédire l’âge d’apparition des symptômes en utilisant uniquement la taille de l’allèle (Martorell, Monckton et al., 1998). Dans les écrits, des corrélations significatives ont été trouvées entre le génotype et certains phénotypes (par exemple, l’âge d’apparition des symptômes), alors que d’autres corrélations ne sont pas claires, suggérant l’implication d’autres facteurs dans cette maladie (Harris, Moncrieff et al., 1996).
La DM1 est une maladie multisystémique chronique transmise avec une pénétrance incomplète (Harper 2001). La pénétrance, principalement utilisée pour les troubles dominants, est définie par la probabilité qu’une personne, possédant un génotype spécifique, présente les manifestations cliniques de cette maladie (Zlotogora 2003). La DM1 affecte principalement les muscles squelettiques et est caractérisée par une dégénérescence progressive, entraînant une faiblesse et une atrophie musculaire (Timchenko 2013). De plus, diverses manifestations cliniques ont été rapportées, notamment des atteintes cardiaques (anomalie de la conduction cardiaque, cardiomyopathie), des cataractes, la maladie pulmonaire restrictive, le syndrome de l’apnée du sommeil centrale et obstructive, des anomalies endocriniennes croissantes (hyperglycémie, insulino-résistance, diabète et dysfonctionnement de la thyroïde) et également des troubles cognitifs (Schara and Schoser 2006, Bouhour, Bost et al., 2007, Kiyan, Okumus et al., 2010, Zalonis, Bonakis et al., 2010, Malatesta, Giagnacovo et al., 2011, Dahlqvist, Orngreen et al., 2014, Khoshbakht, Soltanzadeh et al., 2014).
Manifestations cliniques de la DM1
Les manifestations cliniques, les antécédents familiaux et les tests d’ADN des leucocytes plasmatiques sont quelques-uns des indicateurs utilisés dans le diagnostic de la DM1. Les caractéristiques cliniques distinctives de la DM1 comprennent une faiblesse bifaciale précoce, une ptose bilatérale bénigne, une faiblesse musculaire du cou et une diminution de la masse musculaire des muscles temporaux impliqués dans la mastication (Avaria and Patterson 1994, Schara and Schoser 2006). Au niveau des muscles squelettiques, la faiblesse et l’atrophie musculaire se manifestent initialement dans les muscles distaux et se propagent dans la partie proximale (Thornell, Lindstom et al., 2009). Dans les premiers stades de la maladie, une faiblesse importante des muscles fléchisseurs des doigts est rapportée, affectant ainsi la dextérité manuelle chez les personnes atteintes de DM1 (Whittaker, Ferenczi et al., 2006). Parmi les premiers symptômes rapportés par ces individus se trouve une myotonie des muscles distaux (Contardi, Pizza et al., 2012), suivis d’une progression de la faiblesse musculaire, indépendamment de l’âge et de la durée de la maladie (Sansone, Gandossini et al., 2007).
En plus de son implication dans la myopathie des muscles squelettiques, l’ARNm de la DMPK mutant est largement exprimé dans les neurones corticaux et souscorticaux et il est suggéré que les anomalies du gène DM1 affectent davantage le cerveau que le cervelet (Endo, Motonaga et al., 2000, Jiang, Mankodi et al., 2004). Des données supplémentaires appuient maintenant l’idée que la DM1 devrait être considérée comme un trouble cérébral (Bird, Follett et al., 1983, Meola 2010, Laberge, Gagnon et al., 2013, Caso, Agosta et al., 2014), avec un dysfonctionnement généralisé du système nerveux central (SNC) (Perini, Colombo et al., 1989). Le point clé de la DM1 est que les déficits cognitifs sont la conséquence directe de l’atteinte du SNC, plutôt que la conséquence d’une maladie musculaire. Il existe certains éléments suggérant que le déficit cognitif ne va pas de pair avec une incapacité physique croissante, soutenue par certains individus présentant des déficiences intellectuelles avant les déficits musculaires (Spranger, Spranger et al., 1997). En accord avec ces derniers, d’autres préconisent la distinction entre ces deux processus indépendants, les atteintes du SNC et les atteintes musculaires (Meola 2014, Peric, Pavlovic et al., 2014).
Les symptômes résultant des anomalies du SNC chez les DM1 comprennent des atteintes cognitives, la somnolence diurne excessive (Hermans, Merkies et al., 2013), l’apathie, le retrait des activités sociales et le manque d’initiative (Colombo, Perini et al., 1992, Rubinsztein, Rubinsztein et al., 1998), l’anxiété et la dépression (Colombo, Perini et al., 1992, Meola, Sansone et al., 1999, Meola, Sansone et al., 2003, Antonini, Soscia et al., 2006, Meola and Sansone 2007, Winblad, Jensen et al., 2010, Minnerop, Weber et al., 2011, Caso, Agosta et al., 2014, Rakocevic Stojanovic, Peric et al., 2014). L’évaluation de la personnalité des personnes atteintes de DM1 a révélé les éléments suivants : traits paranoïaques et agressifs (Sistiaga, Urreta et al., 2010, Peric, Sreckov et al., 2014, Serra, Silvestri et al., 2014), traits de personnalité évitante (Meola, Sansone et al., 2003), traits de personnalité déviante (Winblad, Lindberg et al., 2005), personnalités passivesagressives (Bird, Follett et al., 1983) et traits de dépendance (Palmer, Boone et al., 1994).
Lorsque les scores du quotient intellectuel (QI) sont comparables à ceux de la population normale, les personnes atteintes de DM1 présentent des déficits dans divers domaines neurocognitifs : les fonctions exécutives et la déficience cognitive frontale (incluant, entre autres, les fonctions attentionnelles et la mémoire de travail), la mémoire verbale ou non verbale, la fluence verbale, les capacités visuospatiales et visuoconstructives, et la vitesse de traitement (Censori, Danni et al., 1990, Palmer, Boone et al., 1994, Meola, Sansone et al., 1999, Meola, Sansone et al., 2003, Antonini, Soscia et al., 2006, Winblad, Lindberg et al., 2006, Sansone, Gandossini et al., 2007, Weber, Roebling et al., 2010, Wozniak, Mueller et al., 2014). D’un autre côté, spécifiquement à la forme adulte, Serra et ses collègues (2014) rapportent que les participants DM1 ne présentent qu’un trouble cognitif léger avec des déficits visuospatiaux. D’ailleurs, dans une étude récente, les scores de QI obtenus à l’aide du WAIS-R confirment la présence de déficience intellectuelle chez des participants DM1 atteints par la forme adulte et la forme légère (Jean, Richer et al., 2014).
Introduction |