Diversité spatiale des microorganismes symbiotiques d’Acacia seyal et de graminées des sols salés
La symbiose mycorhizienne
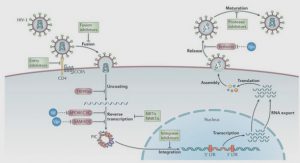
La mycorhize (du grec «mukês» pour champignon et «rhiza» pour racine) est l’association symbiotique d’un champignon avec les racines d’une plante. Ce terme « mycorhize » fut créé, à l’origine, par le phytopathologiste allemand Frank en 1885. Cette association repose sur le fait que les deux partenaires retirent des avantages de cette liaison (Smith & Read, 2008) Synthèse bibliographique Dans la nature, l’état de mycorhization est la règle et celui de non mycorhization l’exception (Strullu, 1991). En effet, plus de 90% des familles de plantes forment des associations symbiotiques avec des champignons. Deux principaux types d’associations mycorhiziennes ont été définis en fonction de la morphologie et de la structure de la mycorhize : les endomycorhizes (constituées par les endomycorhizes à vésicules et arbuscules et les endomycorhizes à pelotons d’hyphes cloisonnées chez les orchidacées et les éricacées) et les ectomycorhizes. A coté de ces d eux grands groupes de symbioses mycorhiziennes, il existe des ectendomycorhizes.
Les ectomycorhizes
Les ectomycorhizes sont, après les mycorhizes à arbuscules, les plus représentés dans les écosystèmes forestiers. Elles concernent 95% des arbres des forêts tempérées et boréales et 5% des arbres des forêts tropicales Smith et Read, (1997). Les champignons responsables de ce type de symbiose sont des Basidiomycètes (Russules, Lactaires…) et plus rarement des Ascomycètes (Truffes, Cenococcum geophilum…). Chez les ectomycorhizes, le mycélium du champignon entoure la racine de l’hôte pour former le manteau fongique visible à l’œil nu (Boulard, 1968). A partir du manteau, des hyphes pénètrent entre les cellules corticales et forment le réseau de Hartig, lieu d’échange entre les deux symbiotes. Les champignons impliqués sont cultivables en l’absence de l’hôte. Cependant, la fructification des champignons ectomycorhiziens n’est possible qu’en présence de la plante hôte.
La symbiose endomycorhizienne
Les endomycorhizes sont les plus répandues et concernent au moins 95 % des taxons végétaux dont des arbres, des plantes agricoles et des herbacées. Ce type d’association ne provoque que peu de changements dans la morphologie racinaire. En effet, elles ne forment jamais de manteau autour des racines. Les champignons endomycorhiziens sont des champignons microscopiques, non cultivables en l’absence de l’hôte. Les hyphes pénètrent à l’intérieur des cellules corticales de l’hôte où ils forment les arbuscules et des vésicules. Les arbuscules se trouvent exclusivement dans l’espace périplasmique des cellules corticales de la racine (Hodge, 2000) et présentent une structure d’hyphes très ramifiée qui augmente considérablement la surface de contact entre le champignon et la plante. Les arbuscules sont le site d’échange de minéraux et de nutriments entre la plante hôte et le champignon (Bever et al., 2001). Synthèse bibliographique Les vésicules sont des organes de réserves lipidiques qui peuvent également endosser la fonction de propagule (Smith & Read, 2008).
Classification des champignons endomycorhiziens
Deux classifications sont proposées : Classification de Morton & Benny Selon la classification de Morton et Benny (1990), les endomycorhizes à vésicules et arbuscules (EVA) appartiennent à la classe des Zygomycètes, avec un seul ordre, celui des Glomales subdivisé en deux sous-ordres : les Glomineae et les Gigasporineae. L’ensemble des espèces connues appartient à l a famille des Glomacées (Pirozynski et Dalpé, 1989) formée des genres Glomus et Sclerocystis. L’ensemble des endomycorhizes compte, actuellement, environ 160 espèces distribuées en trois familles et six genres. Les champignons endomycorhiziens les plus étudiés à l’heure actuelle au sujet des stress hydrique et salin sont Glomus mosseae, Glomus deserticola, Glomus fasciculatum, Glomus intraradices, Glomus etunicatum, Glomus caledonium et Glomus occultum.
Introduction |