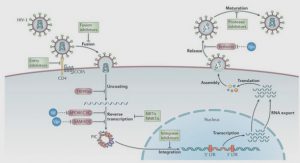
Contribution a l’etude d’une plante hemiparasite de la flore
RECHERCHE DES TANINS
Les tanins sont des composés polyphénoliques ayant la propriété de tanner la peau, c’est à dire de la rendre dure et imputrescible en se fixant sur les protéines. On distingue deux grands groupes de tanins : • les tanins hydrolysables ou pyrogalliques qui sont des esters d’oses et d’acides phénols (acides galliques en particulier), • les tanins condensés, non hydrolysables ou catéchiques qui dérivent des catéchols et des proanthocyanidols par condensation.
Extraction
La caractérisation se fait sur un infusé à 10%. Sur 5 g de drogue, verser 50 ml d’eau bouillante et laisser infuser pendant 30 minutes puis filtrer.
Réactions de caractérisation
Caractérisation par le perchlorure de fer : On ajoute quelques gouttes de solution de perchlorure de fer à 2%, à 5 ml de la solution extractive puis on agite. La présence des tanins est signalée par une coloration brun vert du mélange.
Caractérisation par l’acide phosphotungstique
Les tanins donnent avec l’acide phosphotungstique une coloration bleue. On dilue l’infusé au 1/10e puis on ajoute ensuite à 1 ml de la solution : • 1 ml d’une solution d’acide phosphotungstique, • 9 ml d’une solution aqueuse de carbonate de sodium à 25%. 60 Il apparaîtra une coloration bleue du mélange.
Différenciation des tanins
Elle permet de distinguer les deux catégories de tanins à savoir : • les tanins condensés ; • les tanins hydrolysables.
Précipitation par le réactif de Stiasny
Principe : En milieu acide et à chaud, les tanins condensés sont précipités par le réactif de Stiasny tandis que les tanins hydrolysables restés en solution donnent avec le perchlorure de fer à 2% une coloration bleue, ceci après saturation du filtrat avec l’acétate de sodium. Mode opératoire : Il consiste à ajouter à 15 ml de l’infusé, 8 ml de réactif de Stiasny (formaldéhyde chlorhydrique) puis chauffer au bain-marie à ébullition pendant 30 mn. La précipitation montre la présence des tanins condensés. On filtre et sature le filtrat par l’acétate de sodium, puis on ajoute quelques gouttes de solution de chlorure ferrique à 2% : il apparaît une coloration bleunoir indiquant la présence des tanins hydrolysables non précipités par le réactif de Stiasny.
Oxydation des tanins condensés
Principe : Par chauffage en milieu chlorhydrique, les tanins condensés s’oxydent en phlobaphènes colorés en rouge. Mode opératoire : On ajoute à 5 ml de l’infusé, 1 ml d’acide chlorhydrique puis on porte à ébullition. Il se développe une coloration rouge due à la formation de phlobaphènes. Remarque : Au cours de la conservation des drogues à tanins condensés, une partie de ces tanins s’oxyde en phlobaphènes responsables de la coloration rouge de ces drogues.
Chromatographie sur couche mince des tanins
Préparation des extraits
10g de poudre d’échantillon et 150ml d’éthanol sont placés dans un ballon de 500ml. Le mélange obtenu est porté à ébullition à reflux pendant 30mn, refroidi, puis filtré. Le décocté ainsi obtenu est évaporé grâce à l’évaporateur rotatif (photo 5) et on obtient un résidu sec qui sera repris par du méthanol. La solution méthanolique ainsi obtenue sera utilisée pour la CCM (Figure 4).
Matériel et réactifs
• Support : silice • Solvant de migration : acétate d’éthyle/méthanol/eau (40v/8v/5v) • Dépôts : o Témoin d’acide tannique o Extraits de la plante à analyser • Révélateur : mélange chlorure ferrique, acide acétique, eau (2v/2v/96v)
Technique
Le témoin et les extraits à analyser sont déposés sur la plaque, puis laissés migrer dans la cuve. Après une bonne migration, la plaque de silice est observée sous lampe UV à λ=365 et 254 nm. La plaque est ensuite séchée à 100°C à l’étuve pendant 5 minutes, puis révélée avec FeCl3. Les tanins donnent des taches de couleur noire.
RECHERCHE DES HETEROSIDES ANTHRACENIQUES
Les hétérosides anthracéniques ou anthracénosides sont des substances de structures homogènes dérivées de l’anthracène. Les plantes qui les renferment sont utilisées comme purgatif. La réaction de Borntraeger est utilisée pour la caractérisation des hétérosides anthracéniques.
Principe
Les génines anthracéniques donnent en présence d’un alcali une coloration rouge qui est intense avec les génines oxydés.
Mode opératoire
Le mode opératoire consiste à : • mélanger 25 mg de poudre, 20 ml d’eau, 1 ml de HCl concentré ; • porter au bain-marie pendant 15 mn ; • laisser refroidir ; • extraire, après filtration, avec 10 ml de chloroforme ; • évaporer à sec la solution chloroformique ; • ajouter au résidu 2 ml d’ammoniaque au 1/2. On observe une coloration jaune qui vire au rouge par chauffage au bainmarie.
RECHERCHE DES SAPONOSIDES
Les saponosides sont des hétérosides caractérisés entre autres par leur pouvoir aphrogène en solution aqueuse.
Principe : La drogue est extraite par décoction aqueuse, puis la teneur en saponosides sera évaluée par la détermination de « l’indice de mousse » sur le décocté
Mode opératoire Prépara tion du décocté : Dans un erlenmeyer de 500 ml, mettre: 1g de poudre de drogue, 100 ml d’eau Puis porter au bain-marie à ébullition modérée pendant 30 mn. On filtre après refroidissement et on ajuste à 100 ml. Mesure de «l’indice de mousse » : IM Dans une série de 10 tubes calibrés numérotés de 1 à 10, répartir successivement
…10 ml du décocté
Dans chaque tube, on ajuste le volume à 10 ml par addition d’eau distillée ; Puis on agite pendant 15 secondes dans le sens de la longueur (2 agitations par seconde) ; on laisse reposer 15 mn et enfin on mesure la hauteur de la mousse. Le tube X dans lequel la hauteur de la mousse est de 1 cm va servir de base au calcul de l’indice de mousse. Calculs : X ml de décocté à 1% = X/100g de drogue. Les tubes étant dilués dans 10 ml d’eau, la concentration dans le tube est donc égale à X/1000. L’indice de mousse (IM) est : 65 Remarque: • Si la hauteur de la mousse est inférieure à 1 cm dans tous les tubes, l’indice de mousse est inférieur à 100. • Si cette hauteur est supérieure à 1 cm dans tous les tubes, il faut faire une nouvelle détermination après avoir dilué le décocté au 1/10e ou plus.
RECHERCHE DES HETEROSIDES CARDIOTONIQUES
Ce sont des substances constituées d’une génine de nature stéroïdique sur laquelle sont fixés une fraction osidique et un cycle lactonique insaturé. On les utilise dans le traitement des insuffisances cardiaques.
Principe : Après dégraissage, les hétérosides cardiotoniques donnent en milieu alcalin des réactions colorées avec les dérivés nitrés. Ainsi on obtient les colorations suivantes selon le réactif utilisé : • Baljet : rouge orange stable, • Kedde : rouge pourpre stable, • Raymond-Marthoud : violette fugace.
Mode opératoire
Extraction : Mettre 1g de poudre de drogue en contact deux fois de suite avec 4 ml d’éther de pétrole pendant 3 mn. Décanter et sécher à l’air libre : on obtient une poudre dégraissée. Introduire la poudre dégraissée dans un tube à essai ; ajouter 5 ml de mélange chloroforme/éthanol (4v/1v). Laisser macérer 30 mn en agitant de temps à autre et filtrer.
Caractérisation
Le filtrat est réparti dans trois tubes à hémolyse puis on verse dans chaque tube respectivement : • 0,5 ml de réactif de Baljet, • 0,5 ml de réactif de Kedde, • 0,5 ml de réactif de Raymond-Marthoud. On ajoute dans chaque tube 2 gouttes de lessive de soude dilué au 1/5e dans l’alcool à 95°C puis on agite en s’assurant que le pH est bien alcalin. On observe les colorations décrites ci-dessus.
RECHERCHE DES ALCALOIDES
Les alcaloïdes constituent un groupe chimique très hétérogène, difficile à définir précisément. Le terme alcaloïde est généralement appliqué aux substances organiques, basiques, azotées et douées de propriétés physiologiques.
INTRODUCTION |