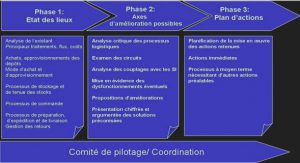
Modélisation des phases fluides
Le rendement d’un procédé de captage de CO2 par formation d’hydrates est fonction de bon nombre de paramètres tels que la composition de la charge à traiter et les conditions opératoires régissant la colonne de formation. Le recours aux promoteurs d’hydrates est indispensable afin d’assurer la viabilité économique du procédé. La nature du promoteur ainsi que sa concentration affectent sensiblement la sélectivité des hydrates vis-à-vis du CO2. Le rendement du procédé de captage dépend essentiellement de la teneur en CO2 de la phase hydrate. En effet, par analogie avec la distillation, où la séparation se fait par concentration de la phase vapeur (constituant le plus volatile), un procédé de captage du CO2 par formation d’hydrates repose sur l’enrichissement de la phase hydrate en CO2 par rapport aux autres éléments présents dans les fumées de postcombustion (N2, O2,…). Selon les spécifications, en termes de pourcentage de pureté en CO2 requis en aval du procédé de traitement, on peut envisager plus d’un étage de formation/dissociation. A chaque étage n, un équilibre hydrate-vapeur s’établit à partir d’une alimentation ou charge de concentration (correspondant à la phase hydrate. Dans le cadre du présent travail, nous considérons le cas où la phase hydrate obtenue dans le réacteur de formation peut être véhiculée via un agent de transport, vers une colonne de régénération où elle sera dissociée en une phase gaz riche en CO2 et une phase aqueuse réutilisable dans un autre cycle de formation. Des études portant sur la formation des hydrates dans des émulsions eau dans l’huile, ont alimenté notre réflexion quant à l’ajout d’un hydrocarbure dans la phase aqueuse. Auquel cas, la phase dispersée (= les gouttelettes d’eau) serait le siège de la formation d’hydrates. L’émulsion eau dans l’huile de départ se transforme alors en une suspension d’hydrates, transportable du réacteur de formation vers le réacteur de dissociation. Toutefois, dans le cadre de cette étude, nous n’intégrons pas cette problématique de transfert des hydrates de la colonne de formation vers la colonne de dissociation.
La phase gaz obtenue constituera l’alimentation de l’étage (n+1). L’ajout du promoteur peut être restreint à la première étape de formation (cf. plus loin). Sa concentration dans la phase aqueuse xp, ainsi que celle dans la phase hydrate Hs’ajouter à la liste des variables du procédé. La figure 67 illustre très schématiquement le principe du procédé. Il est convenu dans les travaux de recherche de Linga et al. (2007 a, b, c) et ceux de Kang et al. (2000) portant sur le captage de CO2 en postcombustion par formation d’hydrates, que l’élément O2 peut être assimilé au N2, étant donné que ces deux espèces forment des hydrates à des conditions similaires. En outre le pourcentage de O2, dans les fumées de combustion, ne dépasse pas les 5 %. Nous avons choisi de porter sur un même graphique deux séries de données d’équilibre H-Lw-V se rapportant aux binaires O2 / eau (Mohammadi et al., 2003) et N2 / eau (van Cleeff, A. et al., 1960), (cf. Figure 68). L’examen de ce graphique montre effectivement deux courbes de dissociation très voisines. Les fumées de combustion seront donc considérées comme un mélange de CO2/N2, où la concentration de CO2 varie de 5 à 17 % mol.
Nous souhaitons clarifier à ce stade, que le procédé réel ne se trouve pas forcément dans un état d’équilibre thermodynamique. La simulation complète du procédé réel doit évidemment intégrer les aspects cinétiques et les phénomènes de transfert. Nous avons néanmoins figé les étapes de formation et de dissociation dans leurs états d’équilibre thermodynamique, pour la détermination des conditions opératoires du procédé. La détermination de la composition des phases à l’équilibre repose sur la résolution d’un algorithme de flash (Vidal, 1997). Le principe d’un tel algorithme a été amplement détaillé dans le travail de Michelsen M. (1982). La mise en œuvre du flash nécessite que l’on dispose des fugacités des différentes espèces i constituant le système, dans toutes les phases présentes à l’équilibre thermodynamique, lequel est régi par l’égalité des températures et des pressions des différentes phases ainsi que par l’équation d’équifugacité (Eq. 1) : L’élément i peut être tout constituant des fumées de combustion, l’eau ou encore la molécule promotrice présente dans la phase aqueuse. Nous allons décrire dans ce chapitre, les modèles thermodynamiques choisis pour le calcul des fugacités, i.e. les modèles ayant permis la prédiction des coefficients de partage des différentes espèces entre les phases présentes à l’équilibre thermodynamique. La modélisation des phases fluides (Aq et V) sera abordée en premier. Nous traiterons par la suite la modélisation de la phase hydrate. Le déplacement de l’équilibre thermodynamique, suite à l’ajout de promoteurs sera aussi pris en compte dans une étape ultérieure.