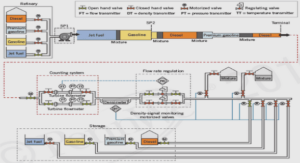
Comparaison entre l’effet des mélanges Fe2+/TiO2 et Fe3+/TiO2
Pour les concentrations utilisées pour les deux additifs, on note une légère amélioration par rapport à sa dégradation sans aucun ajout. En effet, pour une sonolyse du substrat seul en solution l’élimination s’achève en 60 min à pH 3. Cependant, un taux maximal de dégradation est obtenu pour une concentration de 15 mg/L de Fe2+ et de 100 mg/L du catalyseur, soit un rendement de 100% après 25 min de traitement, pour des quantités supérieures ou inférieures à cette concentration en TiO2, la dégradation ralentit. Ces résultats confirment ceux obtenus lors de l’étude des deux additifs séparément.D’autre part, la concentration du catalyseur est maintenue égale à 100 mg/L et la concentration des ions Fe2+ est variée (5, 10, 15, 20 mg/L), et la Figure II.11 présente les différentes variations observées.Les vitesses initiales de dégradation du BR 29, en présence et en l’absence des différents additifs sont présentées sur la Figure II.12. La vitesse initiale de dégradation du BR29 sous l’action unique des ultrasons est de 1,41 mg/L min et elle augmente d’un facteur égale à 1,7 en présence du mélange Fe2+/ TiO2 pour atteindre 2,47 mg/L min. Comme il a été constaté précédemment, l’action des ions Fe2+ est plus prononcée que celle du TiO2. Des résultats semblables ont fait l’objet des travaux de Madhavan et al. [59] lors de la dégradation de l’Ibuprofène. L’ensemble des résultats peut être expliqué par l’effet additionnel de deux phénomènes, i) la catalyse par les particules de TiO2, où les molécules du substrat viennent s’adsorber sur des sites rendus actifs par l’action des ultrasons, notamment à des pHacides. En effet, pour des pH inferieurs à la valeur du pHpzc du catalyseur, sa surface est chargée positivement, et l’accélération de l’élimination du BR 29 est attribuée à l’interaction entre les molécules du substrat et la surface des particules chargée positivement et ii) le procédé Fenton qui génère des radicaux HO• par la décomposition du peroxyde d’hydrogène et qui agissent favorablement sur la destruction de la molécule du substrat dans les milieux aqueux [60,61].
Un procédé d’oxydation utilisant l’activation du peroxyde d’hydrogène par les selsde fer est connu comme étant l’oxydation par le procédé de Fenton qui est efficace dans la destruction de nombreux polluants organiques dangereux dans l’eau.Pour pouvoir comparer l’effet des deux mélanges Fe2+/ TiO2 et Fe3+/ TiO2, des solutions de Basic Red 29 ont été préparées en présence de 15 mg/L de Fe2+ ou de Fe3+ et de 100 mg/L en TiO2 puis irradiées (300 kHz et 39 W). Les histogrammes présentés sur la Figure II.13 expriment nettement l’écart entre l’effet du mélange fer ferreux/catalyseur et celui du fer ferrique/catalyseur. La vitesse initiale de dégradation est estimée à 2,47 mg/L min pour l’association Fe2+/ TiO2 tandis que la vitesse initiale est de 1,85 mg/L min pour Fe3+/ TiO2.Le mécanisme Fenton traditionnellement admis est représenté par une série d’équations, et les vitesses de ces réactions ont été bien décrites dans la littérature [63]. La réaction (II.30) est reconnue en tant que réaction de Fenton et implique l’oxydation du fer ferreux en fer ferrique pour décomposer le H2O2 en radical hydroxyle. Elle est généralement considérée comme le noyau de la réaction de Fenton. De plus, d’autres réactions doivent être considérées pour comprendre l’ensemble du processus.
Les ions ferriques engendrés peuvent être réduits par réaction avec du peroxyde d’hydrogène en excès pour former des ions ferreux à nouveau et plusieurs radicaux comme indiqué par la réaction (II.31). Cette réaction, appelée réaction de Fenton- like, est plus lente que la réaction de Fenton qui permet la régénération de Fe2+ dans un mécanisme cyclique efficace. Pour des concentrations plus élevées en Fe(III), formé par décomposition sono-induite du complexe Fe-OOH2+, peut devenir en excès dans la solution par rapport à l’H2O2, ce qui diminue la production des radicaux hydroxyles à partir de la réaction de Fenton [64,65].
Abattement de la DCO
Afin de pouvoir vérifier si l’oxydation de la molécule du départ est complète (le Basic Red 29), il s’avère nécessaire d’effectuer des mesures de la DCO au cours du traitement ultrasonore. La mesure de la DCO au cours du traitement a donc été réalisée.Dans un premier temps, on a évalué la concentration du composé initial ainsi que la DCO d’une solution aqueuse de BR29 (30 mg/L) au cours du traitement sonochimique. Les résultats obtenus sont présentés sur la Figure II.14.Les résultats de la Figure II.14 montrent clairement que l’action des ultrasons, sielle élimine complètement le BR29 après 120 minutes d’irradiation, ne conduit pas à une oxydation complète de la charge organique contenue dans la solution même après une longue durée de traitement (240 minutes). Un rendement d’oxydation relativement faible de l’ordre 27,6% est atteint après 240 minutes de sonolyse. Ces résultats soulignent le fait que les produits de dégradation du BR29 sont récalcitrants au traitement sonochimique. La possibilité de la formation d’intermédiaires hydroxylés [27,66] de caractère plus hydrophile que le BR29 constitue un autre facteur qui peut expliquer la faible efficacité de l’action ultrasonore sur l’abattement de la DCO. De nombreux travaux ont clairement démontré que, dans la sonochimie de l’eau, l’efficacité de la capture des radicaux HO• par un composé organique est contrôlée par l’hydrophobicité de ce composé dans la solution .