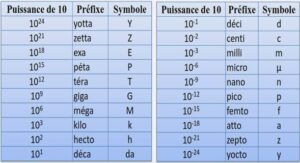
ETUDE DE MINERAIS AURIFERES PAR VOIE ELECTROCHIMIQUE
LE SYSTEME ELECTROCHIMIQUE EN EQUILIBRE ET HORS EQUILIBRE
Le système électrochimique peut être sous deux états différents: équilibré ou déséquilibré que nous citons ci-dessus. Ainsi que les conséquences de ces états.
ETAT D’EQUILIBRE
L’équilibre électrochimique pour un s ystème Red/Ox quelconque est présenté par la réaction: Ox + ne─ ↔ Red Exemple: Mn+ +ne─↔ M (dans le cas d’un élément métallique) Le transfert de charge à l’interface électrochimique est rendu possible, grâce à la présence de tous les constituants électrochimiques du système. L’état d’équilibre correspond à l a compensation exacte des transferts dans les deux sens, de sorte que le transfert de charge ne soit nul (pas d’évolution chimique du système, en conséquence) [5].
Potentiel redox
C’est une grandeur phys ique représentée par la lettre E. Il s’agit en effet d’une différence de potentiel électrochimique (exprimée en volt(V)). C’est la différence de potentiel existant entre une électrode métallique (plus généralement un conducteur électronique) en équilibre avec la solution considérée et une électrode de référence (c’est-à-dire une seconde électrode en équilibre avec une solution particulière dans un état d’oxydation fixé) [8]. E représente le potentiel de galvanie , qui est une différence de potentiel interne / φ ═ χ + ψ avec χ : potentiel de surface ψ : potentiel externe (c’est la tension entre l’extérieur de la surface d’un objet chargé et le vide) [9]. CHAPITRE I : Etudes Bibliographiques 8 Le potentiel électrique interne φ est la différence de potentiel minimal nécessaire pour amener du vide un électron du bas de la bande de conduction. La position du bas de la bande de conduction par rapport au vide vaut donc: -qe .φ, dans l’échelle particulaire (si qe est la charge d’un électron), et -F φ dans l’échelle molaire [10]. Ainsi l’expression du pot entiel électrochimique des électrons libres d’une électrode (travail pour amener une mole d’e- du vide vers une phase) devient: ═ ─FφM (3,1) φM : potentiel électrique interne du métal; ═ : potentiel chimique d’un électron de celui-ci (invariable à T, P constantes et caractéristique de l’état chimique du métal) [8]. F= NA. e ═ 96484, 56 coulomb (c’est la charge d’une mole d’e- , ou faraday). Il vient donc pour deux conducteurs constitués du même métal M (donc ayant la même valeur de ): E= = (3,2) : Potentiel électrochimique des électrons libres de l’électrode : Potentiel électrochimique des électrons libres de l’électrode de référence
La relation de Nernst
La thermodynamique des solutions montre qu’on peut relier à la différence de potentiel électrochimique des constituants du système redox en solution. D’où au rapport des activités de ces constituants: (3,3) En tenant compte de la relation: , pour les constituants en solution, nous en déduisons la relation appelée formule de Nernst: CHAPITRE I : Etudes Bibliographiques 9 E= (3,4) = γC: activité; γ: coefficient d’activité; C: concentration molaire. 3.2 ETAT HORS EQUILIBRE La production constante d’entropie interne (2em principe de la thermodynamique) caractérise les conditions hors équilibre, en électrochimie cette croissance d’entropie s’est traduite par des surtensions, c’est-à-dire par l’écart qui apparait entre le potentiel d’abandon (i=0) donné par la loi de Nernst et le potentiel de fonctionnement (i≠0). L’électrochimie fondamentale essaie, en grande partie, de modéliser le phénomène de surtension. Nous verrons dans la suite que cela fait intervenir un grand nombre de processus différents et complexes. Qui se superposent les uns aux autres : cinétique de transfert électronique, effet de joule, transfert de matière, effets non faradiques [11] liés à l’existence de la double couche, au point de contact entre l’électrode et la solution, effets qui sont responsables du courant capacitif. 3.2.1 Entropie et Surtension Le système redox est nécessairement hors équilibre, lorsqu’un courant circule dans la cellule galvanique (i≠0). A i=0 (l’équilibre), la tension de la réaction est donnée par Er= -A/nF. Dans le cas contraire la tension sera E. L’affinité électrochimique s’écrit, = A +EnF, c’est-à-dire, r), relation que l’on trouve facilement en remplaçant l’affinité chimique par sa valeur A = ─ nFEr On voit que l’état d’équilibre est définit par E=Er et =0. Ce qui nous prouve que l’affinité électrochimique est liée à la différence de potentiel pour le circuit fermé (i≠0) et le circuit ouvert (i=0) cette différence E-Er est appelée surtension son symbole estη. ⇒ r) ═ nFη ═ CHAPITRE I : Etudes Bibliographiques 10 D’où η (3,5) 0 (2nd principe de la thermodynamique), η est de même signe que dξ, qui est de même Que le courant i. dξ en charge (fonction électrolyseur), dξ en charge (fonction générateur).
Cinétique d’un processus électrochimique simple
Nous avons vu que la vitesse des réactions électrochimiques est directement reliée au courant i. Nous savons aussi qu’une réaction ne peut se produire que dans un do maine de potentiel. Il doit donc exister une relation entre la vitesse et le potentiel, ou entre le courant et le potentiel. C’est sur l’étude des courbes intensité/potentiel qu’une très grande partie de l’électrochimie repose. Ces courbes donnent des informations sur les potentiels de réaction (autrement dit les paramètres thermodynamiques) et sur les cinétiques. C’est un moyen très puissant pour appréhender les mécanismes réactionnels, mais aussi pour comprendre, par exemple, les performances des couples redox qui sont utilisés dans les accumulateurs .
INTRODUCTION |