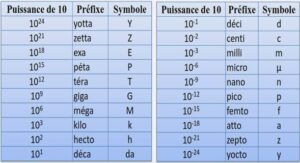
Malgré des progrès et des améliorations sensibles depuis Loosanoff et Davis (1963), l’élevage larvaire de mollusques bivalves en écloserie ne constitue pas encore un procédé totalement fiable et reproductible. De nombreuses variations en terme de survie, de croissance, de taux de métamorphose attestent la difficulté à contrôler les différents paramètres d’élevage. Sans prétendre à la production de larves homogènes, tel un produit industriel, avec le risque de perdre les qualités nécessaires pour affronter les conditions naturelles de l’environnement, il semble toutefois possible de réduire les risques de production et d’en améliorer les performances. Si les méthodes zootechniques sont essentielles dans la maîtrise de ce type d’élevage, de même que le suivi de la qualité des gamètes, de l’eau ou des algues utilisées pour la nourriture, le contrôle des pathologies reste un élément primordial. En effet, des maladies infectieuses peuvent fortement perturber les productions et porter atteinte à la fiabilité des écloseries. Souvent, l’importance des pontes, en terme de quantité et de fréquence, supplée aux aléas de production. C’est d’ailleurs pour cette raison que la connaissance des épisodes de mortalité qui ont cours dans les écloseries commerciales est très limitée. Il suffit en effet de quelques élevages réussis pour assurer la production annuelle et les professionnels ne souhaitent pas, pour des raisons commerciales et de crédibilité, que l’on s’attarde sur les accidents d’élevage.
Néanmoins, depuis le démarrage de l’activité des productions contrôlées de bivalves, de nombreuses mortalités dues à des maladies infectieuses, ont été rapportées. Il semble qu’elles ne menacent plus actuellement les élevages grâce à la mise en oeuvre de procédures sanitaires prophylactiques (Elston, 1984) ou de méthodes thérapeutiques. Ces dernières ne sont cependant pas toujours inoffensives et doivent être optimisées. L’utilisation d’antibiotiques, à titre curatif et même préventif, est en effet une pratique couramment répandue. Les écloseries et les nurseries peuvent être la source de multiplication et de dissémination de pathogènes dans l’environnement. L’épisode récent de l’herpès-virus, qui infecte à la fois les larves et les juvéniles d’huître creuse (Crassostrea gigas) en France, montre combien cette phase d’élevage représente un risque de dissémination. Aussi, il paraît souhaitable que des laboratoires continuent à étudier les causes de mortalités pour, d’une part, en dresser l’inventaire, et d’autre part, en appréhender les mécanismes.
Les agents infectieux connus sont principalement bactériens. Il faut cependant y ajouter un irridovirus (Leibovitz et al., 1978; Elston et Wilkinson, 1985), pathogène pour les larves de C. gigas (OVVD pour Oyster velar virus disease ); également, l’herpès virus, depuis 1991, en France et en Nouvelle-Zélande, qui touche à la fois les larves et les juvéniles de C. gigas et d’Ostrea edulis et peut provoquer des mortalités massives (Nicolas et al., 1992b; Hine et al., 1992).
Dès 1965, Tubiash et al. décrivent des nécroses bactériennes sur les larves de mollusques aux Etats-Unis. Les larves et les juvéniles de l’huître américaine C. virginica sont l’objet de nombreux épisodes de maladies bactériennes décrits notamment par Brown en 1973 et 1981, par Brown et Losee (1978) et par Elston et Leibovitz (1980a). Aux USA, Disalvo et al. (1978) rapportent des mortalités larvaires de l’huître japonaise (C. gigas) et de l’huître plate (O. edulis) provoquées par des vibrios. Jeffries, en 1982, décrit le même type de phénomène pour ces deux espèces en Grande-Bretagne. Garland et al. (1983) relatent également des mortalités larvaires de C. gigas dans les écloseries de Tasmanie et en attribuent la responsabilité à des vibrios. Les écloseries espagnoles sont aussi atteintes par des mortalités d’origine bactérienne de larves d’O. edulis (Bolinches et al., 1986; Lodeiros et al., 1987).
Les huîtres ne sont pas les seuls bivalves touchés puisque, dès 1959, Guillard décrit des maladies bactériennes chez le clam Mercenaria mercenaria, suivi en 1982 par Elston et al., et par Brown et Tettelbach (1988), puis chez Tapes philippinarum par Nicolas et al. (1992a). Les genres Argopecten et Pecten ne sont pas plus résistants puisque Riquelme et al., en 1995, décrivent des mortalités larvaires au Chili, et Nicolas et al. (1996) sur les côtes françaises. Quatre genres bactériens ont été mis en évidence dans ces phénomènes de mortalités sur les bivalves. Ce sont les genres Pseudomonas (Brown, 1974), Alteromonas (Garland et al., 1983), Aeromonas (Riquelme et al., 1996) et Vibrio (Guillard, 1959; Tubiash et al., 1965; Brown, 1973 et 1981; Brown et Losee, 1978; Elston et Leibovitz, 1980a; Jeffries, 1982; Garland et al., 1983; Hada et al., 1984; Bolinches et al., 1986; Lodeiros et al., 1987; Brown et Tettelbach, 1988; Lee et al., 1995 et 1996; Riquelme et al., 1995; Nicolas et al., 1996; Borrego et al., 1996b; Riquelme et al., 1996). Le genre Vibrio est donc, de loin, le genre le plus souvent retrouvé comme agent étiologique dans les élevages de bivalves. En France, le développement des écloseries de bivalves a été accompagné d’épisodes de mortalités dus à la présence de vibrios pathogènes. Ainsi, pour l’élevage de larves de coquille Saint-Jacques (Pecten maximus) en Rade de Brest ou à Argenton (Bretagne) un traitement antibiotique, au chloramphénicol à 8 mg.L-1 (Le Pennec et Prieur, 1977) est toujours appliqué à titre préventif et de façon systématique (Robert et al., 1996). Les antibiotiques sont parfois utilisés dans les élevages de C. gigas en cas de mortalités anormales ou d’arrêt de croissance.
Dans les écloseries d’Argenton et du Tinduff, des mortalités apparaissent systématiquement dans les élevages larvaires de P. maximus dès que l’antibiotique n’est plus distribué. Cette constatation est à l’origine de différents travaux. Dès 1990, mais également en 1991, 1992, 1993 et 1995, des souches de vibrios ont été isolées de larves moribondes de P. maximus à Argenton. Ces souches ont été nommées respectivement A060, A365, A496, A601 et A700. Le caractère pathogène de certaines de ces souches a été démontré et la maladie partiellement décrite (Nicolas et al., 1996). Cependant, aucun travail sur l’identification précise des souches, ni sur les modes d’infection, n’avait été réalisé. Aussi, au départ de ce travail, nous nous proposions d’étudier d’une façon approfondie cette maladie larvaire. Pour ce faire, nous disposions d’un ensemble de souches pathogènes ou potentiellement pathogènes pour les larves de P. maximus (A060, A365, A496, A601 et A700) ainsi que des souches isolées de larves moribondes de C. gigas et O. edulis, prélevées en écloseries commerciales.
I. INTRODUCTION |