Intérêt du dépistage et du suivi de la BPCO
post-tabagique en cabinet de médecine générale par la spirométrie
Introduction
La bronchopneumopathie chronique obstructive (BPCO) est définie selon le Collège des Enseignants de Pneumologie par une obstruction permanente et progressive des voies aériennes (1,2). La BPCO est une pathologie fréquente handicapante par sa chronicité (3) et ses fréquentes exacerbations qui la caractérisent (4). Une exacerbation est définie comme étant un évènement aigu avec aggravation durables des symptômes respiratoires (> 2 jours) au-delà des variations habituelles et imposant une modification du traitement (1). En France, 22 % des personnes souffrant de BPCO ont été hospitalisés au moins une fois dans leur vie pour une BPCO et 11 % l’ont été dans l’année écoulée (5). Selon le PMSI, en 2007, le nombre total de séjours en rapport avec une exacerbation de BPCO était compris entre 69 000 et 112 000 (5). Une enquête internationale en population générale (Confronting COPD Survey) a estimé la prévalence de la BPCO en France à 3,2 % des personnes de plus de 45 ans ayant fumé plus de 10 paquetsannées (6). Dans une étude conduite dans les centres d’examen de santé (CES) en 2003 et comportant une mesure de la fonction respiratoire, la prévalence de la BPCO était de 7,5 % (6). Dans la littérature, les estimations de prévalence varient de 0,2% à 37% (7). Même si la prévalence est méconnue, les exacerbations de BPCO qui caractérisent cette pathologie engendrent des coûts (8) liés aux hospitalisations répétées et ont une incidence sur la mortalité (5). Bien que les taux de mortalité semblent avoir diminué au cours des dernières années, plusieurs études ont rapporté que ce taux a augmenté chez les femmes atteintes de BPCO alors qu’il a diminué chez les hommes (7). Il semblerait que la différence dans ces tendances soit le reflet de la prévalence du tabagisme (9). En effet, bien que d’étiologies multiples (exposition à des aérocontaminants d’origine professionnelle, pollution domestique) le tabagisme reste l’une des causes les plus fréquentes de BPCO (1,2). Les fumeurs de cigarette développent plus fréquemment des symptômes respiratoires et des anomalies de la fonction pulmonaire (10). Dans cette population, on note par ailleurs un taux de déclin annuel du VEMS plus élevé et un taux de mortalité par BPCO plus élevé que les nonfumeurs (10). D’autres types de tabac (pipe, cigare) et le cannabis sont également 3 des facteurs de risque de BPCO (10). L’exposition passive à la fumée de cigarette, également connue sous le nom de fumée de tabac environnementale, peut également contribuer aux symptômes respiratoires de la BPCO (10). En novembre 2013, l’Observatoire Régional de la Santé a réalisé un diagnostic de territoire sur la ville de Port-Saint-Louis-du-Rhône, celui-ci montre, outre une forte vulnérabilité sociale de la population vivant à Port-Saint-Louis-du-Rhône, une surmortalité par rapport aux Bouches-du-Rhône de 77 % pour les pathologies de l’appareil respiratoire (11). Le diagnostic de ce trouble ventilatoire obstructif (TVO) requiert obligatoirement une spirométrie avec mesure du volume expiratoire maximal à la première seconde (VEMS) et de la capacité vitale forcée (CVF)(12). La spirométrie mesure les volumes d’air mobilisés par les mouvements respiratoires et les débits ventilatoires (12) (Annexe 1). Elle permet, en plus de poser le diagnostic de BPCO, d’évaluer la sévérité de la BPCO grâce à la classification GOLD (12) (Annexe 2). Celle-ci a été revue récemment mais n’a toujours pas été adoptée par les recommandations françaises (HAS et SPLF) telles qu’elles sont présentées dans le nouveau rapport GOLD 2017 (10). Actuellement, l’intérêt de réaliser une spirométrie de dépistage en population générale n’est pas démontré (13), mais un dépistage ciblé des patients identifiés à risque de BPCO est recommandé (14). Or, les patients à risque ont peu recours à la spirométrie (15), ce qui entraine un retard diagnostic et une sous-estimation de la sévérité de la pathologie (16). La Haute Autorité de Santé (HAS) a publié en 2014 le guide du parcours de soin de la BPCO , les objectifs de ce guide étant d’expliciter le processus de prise en charge d’une personne ayant une BPCO en médecine de ville et notamment en médecine générale (12). La première étape de ce guide consiste à repérer les facteurs de risque d’être atteint d’une BPCO puis à en faire le diagnostic par la spirométrie chez les sujets à risque. Il est également notifié que le médecin doit s’attacher à évaluer la sévérité de la BPCO, détecter les éventuelles complications et les comorbidités associées (12). Le médecin généraliste doit avoir recours au pneumologue pour confirmer le diagnostic si nécessaire ou en cas de suspicion de forme sévère (évaluation de la gravité par le score BODE cf. Annexe 5), ou bien si des examens complémentaires sont nécessaires (comme une pléthysmographie, un test de marche de 6 minutes, une oxymétrie nocturne, dosage de l’α 1 antitrypsine si forme d’emphysème évocatrice d’un déficit etc..)(12).
Facteurs limitant l’équipement d’un spiromètre
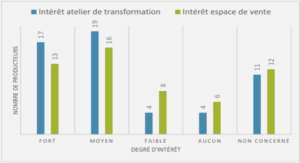
Pour 71,7% des médecins généralistes ne possédant pas de spiromètre (soit 38 praticiens), le principal facteur limitant l’équipement était la présence d’un pneumologue de proximité. De plus, 41,5% de notre effectif (soit 22 médecins généralistes) estimaient ne pas être formés à la réalisation de spirométries en cabinet. Les principaux facteurs limitants étaient mentionnés dans la Figure 8 ci-après. Il est à noter que sur les 54 médecins généralistes ne possédant pas de spiromètre, un praticien a omis de répondre aux questions concernant les facteurs limitant l’équipement d’un spiromètre ainsi qu’à celle traitant des facteurs limitant la réalisation théorique des spirométries
- Facteurs limitant la réalisation de spirométries en cabinet
Concernant plus particulièrement les facteurs limitant l’utilisation théorique de la spirométrie en cabinet de ville, on compte en premier lieu le caractère chronophage de la manœuvre pour 81,1% des médecins généralistes ne possédant pas de spiromètre (soit 43 médecins généralistes) puis la rémunération insuffisante pour 24,5% (soit 13 médecins généralistes) (cf. Figure 9).
Discussion
Les caractéristiques épidémiologiques de notre étude de 60 médecins généralistes confortent les données de la littérature. En effet, la moyenne d’âge était de 52 ans, ce qui correspond aux résultats énoncés dans une étude française à plus grande échelle (de 103 013 médecins généralistes) avec une moyenne d’âge entre 50 et 58,4 ans (20), ou comme une autre étude diligentée par l’ordre des médecins avec une moyenne d’âge de 52 ans (21). Le genre masculin était également prépondérant dans notre population d’étude, en accord avec la littérature (21). Concernant le mode d’exercice, les données de l’atlas de la démographie médicale estiment à 39% la proportion de médecins généralistes exerçant en individuel contre 60% qui exercerait en groupe dans la région Provence Alpes Côte d’Azur (21). Rappelons que dans notre effectif, 55% des médecins généralistes déclaraient exercer en groupe contre 33% individuellement. Concernant les connaissances théoriques de notre échantillon, 88,3% de notre effectif total déclaraient connaitre les recommandations de la HAS, 48,3% basaient leur pratique quotidienne sur les recommandations de la HAS uniquement. Nos résultats sont conformes à une étude réalisée en 2015 à partir des données de l’observatoire de médecine générale sur « La prise en charge de la BPCO par les médecins généralistes » qui retrouvait une différence significative entre les recommandations et la pratique observée, mettant ainsi en évidence plusieurs facteurs liés au patient et/ou au médecin généraliste associés à un moindre suivi des recommandations (22). Dans notre étude, les médecins généralistes possédant un spiromètre connaissaient les 16 recommandations de la HAS pour l’ensemble d’entre eux (100%) et se basaient pour 50% d’entre eux sur les recommandations de la HAS et de la SPLF pour leur pratique quotidienne. Les médecins généralistes ne possédant pas de spiromètre connaissaient pour 87 % d’entre eux les recommandations de la HAS et se basaient pour 50% d’entre eux sur les recommandations de la HAS uniquement. A noter que cette différence observée entre nos deux cohortes de médecins généralistes (avec ou sans spiromètre) n’était pas significative. Le pourtour de l’Étang de Berre est une zone densément peuplée, où de nombreuses industries ont été installées depuis plus de 50 ans. La zone Fos-Étang de Berre est ainsi la zone industrielle la plus importante de la région Provence-Alpes-Côte d’Azur (PACA), regroupant sur plusieurs sites un important complexe pétrochimique et sidérurgique. Les industries émettent de nombreux polluants atmosphériques qui en font une des zones les plus polluées en France, malgré l’instauration de normes de plus en plus contraignantes et les progrès techniques réalisés par les industriels qui ont permis une diminution des rejets depuis 20 ans (23). La région de l’Etang de Berre est la plus émettrice de dioxyde de souffre (SO2), d’oxyde d’azote (NOX), de composés organiques volatiles (COV) et d’oxyde de carbone (CO) qui sont des gaz irritants ayant un impact sur l’appareil respiratoire (24). L’étude de recherche participative EPSEAL (Allen et al., 2016) a récemment montré chez les habitants de Fos-sur-Mer et Port-Saint-Louis-du-Rhône une élévation par rapport à la moyenne nationale des prévalences d’asthme (+58 %) (25). Cette particularité géographique ne semble pas avoir d’incidence sur la proportion de patients tabagiques atteints de BPCO. En effet, cette proportion, estimée entre 5 et 10% par notre échantillon de médecins généralistes du bassin martégal, est conforme à la prévalence de la BPCO dans la population générale évaluée à 7,5% (
Introduction |