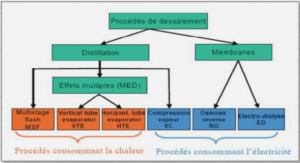
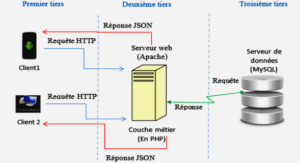
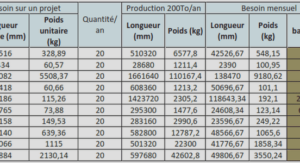
Peptidome de base du stratum corneum
Pour étudier le dégradome de base du stratum corneum, nous avons développé une stratégie basée sur l’ultrafiltration, la reconcentration sur phase solide et l’analyse par LC-MS/MS des échantillons. Dans les études peptidomiques, l’ultrafiltration par centrifugation est la méthode la plus utilisée pour extraire des peptides et éliminer les protéines de haut poids moléculaire [6, 221, 222]. Cette technique exploite un mécanisme d’exclusion stérique grâce à des membranes de seuil d’exclusion spécifique. Ainsi Zheng et al. ont utilisé cette procédure sur des échantillons de sérum et ont identifié 350 peptides endogènes uniques provenant de 61 protéines [223]. Nous avons également utilisé l’ultrafiltration en tant qu’étape de pré- fractionnement. Combiner des membranes d’ultrafiltration de différents seuils (10kDa et 5kDa) nous permet de séparer les peptides en différentes fractions, ce qui augmente la sensibilité de nos identifications. Cependant, de la même manière que cette étape permet de concentrer les composés d’intérêt, les contaminants sont eux aussi concentrés. Leur présence peut réduire drastiquement les performances d’analyse des peptides par spectrométrie de masse. C’est pourquoi, nous avons ajouté une étape de reconcentration des peptides sur phase solide de type ZipTipTM C18, ce qui permet également de dessaler l’échantillon. Enfin l’utilisation d’une séparation chromatographique préliminaire avant l’analyse par spectrométrie de masse est nécessaire pour les études d’échantillons complexes en particulier dans les approches peptidomiques : comme l’échantillon n’est pas digéré à la trypsine, certaines protéines ne seront identifiées que grâce à très peu de peptides, voire un seul. Les analyses MS ont été réalisées sur un instrument hybride LIT-FTICR. Ce type d’appareil nous a permis à la fois de monter en sensibilité et en gamme dynamique afin d’identifier des peptides minoritaires. De plus, la masse des précurseurs est mesurée précisément dans la cellule ICR pendant le scan SIM. Les recherches dans les banques sans digestion in silico sont compensées en diminuant la tolérance de masse à 10ppm. Ainsi le nombre de faux positifs est significativement réduit et les identifications sont plus sûres.
Nous avons analysé des extraits de peptides endogènes de deux types d’échantillons différents : du stratum corneum plantaire où le phénomène de desquamation est moins complet et du stratum corneum non plantaire obtenu à partir de prélèvements non invasifs (stripping) au niveau de la jambe. Au total, 1098 séquences d’acides aminés différentes ont été identifiées, appartenant à 71 protéines (voir le Tableau 10). 21 de ces protéines sont de masse inférieure à 30kDa et peuvent être classifiées comme des protéines de bas poids moléculaire, comme par exemple la cystatine A, la caspase 14, la suprabasine ou encore la calmoduline-like 5. La composition en peptides des deux types d’échantillons est relativement différente. Ainsi certaines protéines ne sont détectées que dans les échantillons de stratum non plantaire comme la filaggrine 2 et au contraire d’autres comme la fatty acid-binding protein ne sont détectées que dans les échantillons de stratum plantaire. De plus lorsqu’une protéine est présente dans les deux échantillons, les peptides identifiés peuvent être partiellement différents. Parmi les enzymes mises en évidence, se trouve par exemple la caspase 14 impliquée dans les phénomènes d’inflammation ou d’apoptose mais aussi dans la prolifération, la différenciation et la cornification [224]. Cette enzyme présente un profil d’expression unique parmi les membres de la famille des caspases puisqu’elle est principalement présente dans les épithéliums cornifiés [225].
Dans la peau, la caspase 14 est uniquement exprimée dans le couches différenciées et cornifiées et dans le follicule pileux [226]. Les procaspases sont constituées d’un prodomaine, d’une grande sous-unité p20 et d’une petite sous-unité p10. Leur activation est induite par dimérisation et (auto)-clivage protéolytique. Contrairement aux autres caspases qui sont processées au niveau d’un résidu aspartate, la caspase 14 l’est au niveau d’un site atypique entre l’Ile152 et la Lys153 [227]. Or nos données ont mis en évidence plusieurs peptides endogènes de caspase 14 avec la Lys153 en N-terminal. En particulier le peptide non plantaire ce qui n’est pas le cas dans les échantillons de stratum plantaire où le peptide le plus identifié est le peptide 87MAHGREGFLKGEDGEMVKLENL108 du prodomaine ou de la grande sous-unité. Cette différence pourrait être due à une activation de la caspase 14 différente selon le type d’échantillon. Parmi les inhibiteurs de protéases identifiés, on trouve la cystatine A. Inhibiteur de protéases à cystéine, il s’agit d’une des protéines précurseurs de l’enveloppe cornifiée des kératinocytes et cette protéine est exprimée durant la dernière étape de différenciation des kératinocytes. Dans nos analyses, nous avons mis en évidence différents peptides tout au long de la séquence. En particulier, l’un des peptides endogènes les plus observés correspond au fragment 2IPGGLSEAKPATPEIQE18. Or il a été montré que la délétion des 8 premiers acides aminés de la cystatine amenait à sa complète inactivation [228]. Il est donc possible que la présence du peptide 2-18 dans nos extraits soit la trace de l’inactivation de cet inhibiteur.