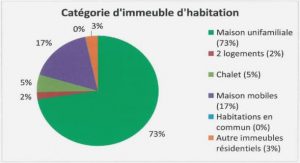
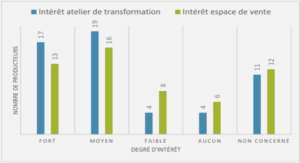
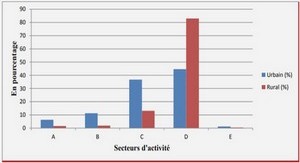
CHAMPIGNONS ENDOMYCORHIZIENS A PELOTONS D’ESPECES EPIPHYTES DU GENRE Angraecum Bory
Les mycorhizes orchidoïdes
Les hyphes des champignons se développent en pelotons (hyphes enroulées) dans l’espace périplasmique des cellules de protocormes, racines, rhizomes et bulbes (Kristiansen et al., 2004). Les champignons impliqués dans la différenciation de ces structures sont 13 morphologiquement très proches des Rhizoctonia et appartiennent principalement à la famille des Ceratobasidiaceae, Tulasnellaceae et Sebacinaceae.
Induction de la germination des orchidées par des champignons endophytes
Quatre stades de développement ont été décrits lors de la germination de graines de l’orchidée terrestre mycohétérotrophe Corallorhiza trifida colonisée par des Thelephoraceae en présence d’arbres ectotrophes (Betula et Alnus) dans un di spositif expérimental (McKendrick et al., 2000) : – stade 1 : colonisation de la graine par des champignons induisant la différenciation de l’embryon et l’enveloppe externe reste intacte (figure 2) ; – stade 2 : développement de la graine provoquant une fente de l’enveloppe externe ; – stade 3 : production des premiers rhizoïdes du protocorme ; – stade 4 : subdivision du protocorme en rhizome d’où vont apparaître les apex caulinaires. McKendrick et al. (2002) ont également décrit la germination de l’orchidée terrestre mycohétérotrophe, Neottia nidus-avis qui présente des similitudes avec celle de C. trifida. N. nidus-avis est, cependant, colonisé par des Sebacinaceae, symbiotes de Fagus sylvatica voisin de l’orchidée. Figure 2 : graines d’orchidées avec une enveloppe et l’embryon (http://www.tropiqualite.fr/?page_id=32) 14 1-3-2- Spécificité associative La distribution géographique des orchidées, en particulier mycohétérotrophes, est déterminée en partie par la spécificité des interactions développées avec les champignons (Tupac Otero et al., 2007 ; Ogura-Tsujita et al., 2008). Les orchidées peuvent être associées à des champignons spécifiques ayant une grande distribution. C’est par exemple le cas d’Eulophia zollingeri associée à l’endophyte spécifique, Psathyrella candolleana (Coprinaceae), champignon décomposeur de bois à très grande distribution (Ogura-Tsujita & Yukawa, 2008). Ceci pourrait expliquer la grande distribution de E. zollingeri en Inde, dans le Sud-Est asiatique et en Australie. Cependant, il n’y a pas de corrélation positive entre la distribution de l’orchidée épiphyte néotropicale, Ionopsis utricularioïdes, et des endophytes spécifiques que sont les Ceratobasidiomycètes (Tupac Otero et al., 2007). On peut dans certains cas observer une association peu spécifique entre orchidées mycohétérotrophes et champignons à très large distribution. Par exemple, Erythrorchis ochobiensis est une orchidée mycohétérotrophe à grande distribution à cause de son association avec une diversité d’Agaricales (Umata, 1997). Les orchidées mycohétérotrophes sont en général très sélectives vis-à-vis des champignons avec lesquels ils s’associent alors que les orchidées mixotrophes sont souvent associées à plusieurs espèces de champignons.
Fonctionnement
Toutes les orchidées sont mycohétérotrophes au moment de la germination (Selosse, 2000). En effet, les graines d’orchidée, de petites tailles et sans réserve cotylédonaire, se différencient en protocorme que si un champignon y pénètre en apportant toute la nourriture nécessaire. Lorsque l’orchidée forme ses feuilles et devient photosynthétique, le champignon persiste dans les parties souterraines de la racine en formant des endomycorhizes à pelotons pour apporter les minéraux du sol sans les substances carbonées que l’orchidée photosynthétique produit elle-même. Cependant, les orchidées mixotrophes, pourtant photosynthétiques, reçoivent une partie de leur carbone de champignons formant des ectomycorhizes avec des arbres voisins. Sur la base des teneurs isotopiques (13C) foliaires, on estime que des orchidées mixotrophes peuvent recevoir entre 9 % et 30 % de leur carbone des champignons (Cameron et al., 2006). En retour, l’orchidée peut fournir au champignon environ 2,6 % de carbone au champignon (Cameron et al., 2006). Les orchidées mycohétérotrophes reçoivent, par contre, la totalité de leur carbone de champignons qui se 15 nourrissent sur les racines des arbres forestiers avec lesquelles ils forment aussi des ectomycorhizes (Selosse & Roy, 2009).
Identification des champignons endophytes
Deux approches sont souvent utilisées pour caractériser et identifier les communautés de champignons colonisant les racines d’orchidée : isolement et culture sur milieu synthétique, et utilisation des outils moléculaires. On peut identifier les champignons à partir de leur morphologie en culture pure (Tupac Otero et al., 2007). Cependant, des contaminants peuvent se développer lors du processus d’isolement à partir des racines préalablement stérilisées superficiellement. De plus, certains champignons ne sont pas cultivables en laboratoire ou ne forment pas de structures reproductrices qui permettent de les identifier. L’approche moléculaire permet de s’affranchir de ces co ntraintes et d’identifier les champignons des orchidées (Tupac Otero et al., 2007 ; Selosse & Roy, 2009). Les techniques de biologie moléculaire (PCR ou réaction de polymérisation en chaine et séquençage) sont basées sur l’analyse de l’ADN total, l’ADN ribosomal nucléaire ou l’ADN ribosomal mitochondrial (Bidartondo et al., 2004 ; Roy et al., 2009). Les régions ITS (Internal Transcribed Spacer ou espaceur intergénique transcrit) et LSU (Large SubUnit ou grande sous-unité) de l’ADN ribosomal nucléaire sont utilisées comme « code-barre » génétique pour caractériser la diversité des champignons (Seifert, 2008 ; Stockinger et al., 2010). La technique PCR permet d’amplifier la région ITS de l’ADN ribosomal nucléaire. L’ADN ribosomal nucléaire existe en plusieurs copies (50 à 100 copies par cellule) et se trouve déjà préamplifié dans les extraits d’ADN. Il comprend des régions codantes pour les ARN ribosomal (18S, 5.8S, 25S et 5S) très conservées au niveau spécifique et des espaces intergéniques, soit transcrit (ITS), soit non transcrit (IGS « Intergenic Spacer »). L’espaceur ITS (ITS1, 5.8S et ITS2) et la région LSU 28S de l’ADNr peuvent être amplifiés par une combinaison d’amorces (ex. ITS1F/ITS4B pour les Basidiomycètes, ITS1F/ITS4 pour les champignons, ITS1F/LR3-Tul pour les Tulasnellalles, ITS1F/LR6-Seb pour les Sebacinales) (White et al., 1990 ; Bidartondo et al., 2004 ; Tedersoo et al., 2008). L’analyse des régions ITS et LSU permet de faire des études d’écologie moléculaire et de systématique des champignons (Tedersoo et al., 2008). Le séquençage des régions amplifiées et la comparaison des séquences avec des bases de données de séquences référencées dans NCBI (National Center for Biotechnologie 16 Information :http://www.ncbi.nlm.nih.gov/blast.cgi), permettent d’identifier la famille, le genre et parfois l’espèce dont on a extrait l’ADN. Figure 3 : Représentation schématique de la région ITS (ITS1, ITS2 et 5.8S) et d’une séquence partielle de 350 pb de la grande sous-unité 28S (LSU) (domaines hypervariables D1-D2-D3-D4) de l’ADNr de champignons. Les flèches représentent les sites de fixation des amorces (Tedersoo et al., 2008
I- INTRODUCTION |