Échec de l’antibiothérapie probabiliste
Lors d’une infection bactérienne, l’hôte, la bactérie, le site infecté et l’antibiotique sont les déterminants de l’évolution du processus infectieux. Ainsi, la définition de l’échec de l’antibiothérapie doit être adaptée, en termes de critère et de délai, selon la combinaison de ces éléments, dont chacun peut par conséquent être impliqué dans l’échec (défenses de l’hôte, résistance bactérienne, accessibilité du site, schéma thérapeutique adapté) [13].
Critères d’échec
L’échec de l’antibiothérapie probabiliste est basé sur les 4 facteurs suivants
– Diagnostic erroné : infection non bactérienne ou
– Infection bactérienne avec profil microbiologique/choix de l’antibiotique erroné ou
– Choix de l’antibiotique correcte mais produits contrefaits ou
– Resistance bactérienne .
L’échec clinique est défini comme la persistance ou l’aggravation des signes cliniques locaux et/ou généraux de l’infection en dépit du traitement antibiotique. En dehors des signes infectieux (température, leucocytose sanguine, marqueurs biologiques de l’inflammation), les signes cliniques retenus diffèrent selon le site infecté. Les échecs microbiologiques diagnostiqués lors des infections documentées sont définis comme l’isolement persistant de la (des) bactérie(s) initialement isolée(s) dans le prélèvement diagnostique.
En raison de l’absence de définition consensuelle, certains auteurs proposent la nécessité d’un changement de traitement antibiotique comme critère d’échec, ou encore le décès, même pendant la phase de traitement initial. L’absence de rechute est finalement le seul critère absolu de guérison d’une infection.
Diagnostics différentiels
Les faux échecs sont :
– Persistance normale du syndrome infectieux,
– Syndrome de défaillance multiviscérale,
– Sensibilisation aux antibiotiques (allergies),
– Complications après administration des antibiotiques,
– Affection sous-jacente.
Présomption bactériologique fausse
Il est fort possible de tomber sur un échec de traitement à la suite d’une erreur sur le germe en cause ou une méconnaissance d’une association de germes. En effet, pour une infection monomicrobienne, le traitement est rendu difficile par un profil de résistance inattendu. Le pari bactériologique est délicat, notamment en cas d’infections graves et surtout avec les Escherichia coli résistants à l’association amoxicilline-acide clavulanique, les entérobactéries sécrétrices de bêtalactamases à spectre étendu (EBLSE), mais également Acinetobacter, Pseudomonas aeruginosa, Enterobacter, Serratia, Citrobacter, sécréteurs d’une céphalosporinase, voire les Stenotrophomonas maltophilia. Dans l’autre cas, le pari bactériologique a méconnu une infection plurimicrobienne. L’existence d’une flore variée est usuelle au cours des péritonites, des infections génitales, et des abcès cérébraux ou hépatiques .
Ré-isolement de la souche initiale restée sensible à l’antibiothérapie
Lorsque la bactérie initiale est toujours présente au-delà d’un délai «anormal» de persistance bactérienne, plusieurs hypothèses sont à envisager. L’échec thérapeutique sera interprété par l’obtention de taux efficaces d’antibiotiques s’appuyant sur des tests spécifiques comme la mesure des concentrations minimales inhibitrices (CMI) et bactéricides (CMB), l’étude du pouvoir bactéricide des associations ou du pouvoir bactéricide du sérum.
– Persistance du foyer infectieux
La présence de matériel étranger dans le foyer infectieux peut entraver l’efficacité de l’antibiothérapie. Par ailleurs, la persistance du foyer infectieux enclos, en particulier abdominal, peut expliquer des hémocultures positives au-delà de 3 jours de traitement chez 19 à 63 % des patients justifiant alors une ponction drainage sous imagerie ou par voie chirurgicale.
– Échec d’origine pharmacologique
L’état du patient comme l’utilisation de certaines techniques sont à même d’induire des modifications de la pharmacocinétique de l’antibiotique. Il existe une augmentation du volume de distribution des antibiotiques chez les patients sous ventilation artificielle. Les troubles de l’hydratation, les altérations des clairances rénales et extrarénales modifient les cinétiques d’élimination, rendant compte de grandes variations individuelles en dépit des règles de prescription, et justifiant la mesure régulière des concentrations sériques au pic et/ou résiduelle. Enfin, la diffusion des antibiotiques aux sites infectieux peut également être altérée en raison de la diminution de la perfusion de certains territoires.
Le choix passe donc obligatoirement par des antibiotiques à bonne diffusion tissulaire et à des posologies suffisantes pour obtenir des concentrations in situ élevées. En outre, la diffusion au sein d’un même foyer infectieux n’est pas toujours homogène. Les interférences médicamenteuses peuvent être à l’origine de situations d’échec. Enfin, les échecs par modification de la biodisponibilité, en particulier pour les voies orale, intramusculaire ou sous-cutanée sont rares en réanimation du fait de leur faible utilisation.
– Échec d’origine pharmacodynamique
Les échecs d’origine pharmacodynamiques sont liés à une bactéricidie insuffisante due à une inadéquation du mode d’administration des antibiotiques. La prescription d’un traitement antibiotique est orientée en partie par le mode d’interaction existant entre l’antibiotique sélectionné et la bactérie en cause.
– Échec d’origine microbiologique
L’effet inoculum des antibiotiques peut être à l’origine d’un échec. C’est un effet surtout démontré in vitro qui correspond à une augmentation de la CMI dans le cadre d’une forte densité bactérienne. Observé surtout avec les bêtalactamines (céfotaxime, pipéracilline), la CMI mesurée au laboratoire serait sous-estimée et donc faussement rassurante. Les antibiotiques qui ont peu ou pas d’effet inoculum sont les aminosides, les fluoroquinolones et l’imipénème. Sinon, il peut s’agir d’un phénomène de tolérance génotypique. En présence de cocci à Gram positif, principalement Streptococcus viridans, entérocoque et Staphylococcus aureus, les bêtalactamines notamment ont un effet bactériostatique mais pas bactéricide du fait d’une forte dissociation entre CMI et CMB. L’association d’un aminoside permet alors d’obtenir l’effet bactéricide.
– Échec liés à l’hôte
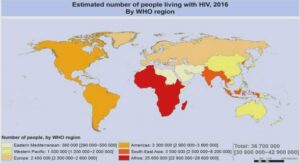
Ce sont des patients très immunodéprimés (VIH, granulomatose familiale) qui présentent essentiellement des retards à la réponse thérapeutique.
INTRODUCTION |