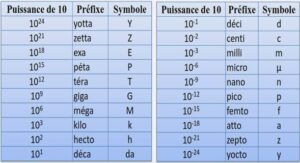
Etude de la formation et la stabilité d’un catalyseur modèle sur les oxydes
Généralité sur les catalyseurs
Catalyse et catalyseurs
La catalyse est une science pluridisciplinaire née au début du XlXéme siècle. La catalyse est introduite par Jöns Jacob Berzelius en 1835 pour décrire un phénomène qui permet de «surmonter les contraintes empêchant des molécules de réagir entre elles ». Mais le mode d’action des catalyseurs n’a été vraiment compris qu’après le développement de la cinétique chimique avec Wilhelm Ostwald (Prix Nobel 1909). La première application industrielle de la catalyse fut la synthèse de l’ammoniaque en 1910 par F. Haber, (prix Nobel 1919) par combinaison entre l’hydrogène et l’azote, mais c’est essentiellement pendant la période de l’entre deux guerres que la catalyse a acquis l’impact important qu’on lui connaît aujourd’hui dans l’industrie. D’autres noms associés à la catalyse sont Irving Langmuir (Nobel 1932) ou Cyril Hinshelwood (Nobel 1956). De nos jours, elle intervient dans de très nombreux procédés industriels : on peut citer à titre d’exemples la production d’énergie à partir des matières plastiques, de carburants et de combustibles, témoignant de la maturation de cette discipline en une science rigoureuse et bien établie [1, 2]. La catalyse en globe est la science qui se rapporte au mode d’action des catalyseurs sur une réaction chimique. Un catalyseur est selon Ostwald, un composé qui permet d’accélérer la vitesse à laquelle un système chimique atteint l’équilibre sans figurer dans l’équation stœchiométrique de la réaction. En premier lieu, il est important de noter que le catalyseur est une espèce qui accélère une réaction et que l’on retrouve non transformée chimiquement à la fin de la réaction. D’autre part, cette définition proposée par Ostwald précise que le catalyseur ne modifie pas les caractéristiques thermodynamiques de l’équilibre qu’il aide à atteindre. Il agit exclusivement sur la cinétique d’une réaction thermodynamiquement possible. Dans le cas où le système a la possibilité d’évoluer selon plusieurs voies thermodynamiquement permises, le catalyseur peut accélérer sélectivement une de ces voies : on dit alors que le catalyseur a un effet d’orientation sur l’évolution du système. Lorsque le catalyseur appartient à la même phase que les réactifs on dit que la catalyse est homogène. C’est généralement le cas des complexes de coordination en milieu organique, ou des acides et bases en milieu aqueux ou aqua-organiques. Si le catalyseur n’appartient pas à la même phase que les réactifs et produits. Le plus souvent, il est solide alors que les réactifs sont gazeux ou liquides. Il s’agit de catalyse hétérogène, appelée également catalyse de contact [3, 4]. Le point clé est lorsque le catalyseur capable d’effectuer dans des conditions optimales une réaction donnée. Il n’existe qu’un petit nombre des catalyseurs réel adaptés à un procédé particulier sont le plus souvent un solide complexe. On distingue les catalyseurs massiques, uniquement constitués de substances actives, des catalyseurs supportés, composés d’une phase active déposée sur un support préalablement mis en forme des avantages par rapport aux massiques : ➢ moins de substance active si celle-ci est rare et chère (Pt, Pd) ➢ meilleure dispersion des substances actives et maintien de celle-ci en cours d’utilisation, ➢ le support apporte des propriétés de texture et de résistance mécanique dont l’optimisation et le contrôle sont déjà connus.
Importance des catalyseurs
Les catalyseurs sont largement utilisés dans l’industrie et en laboratoire, c’est ce qui fait aujourd’hui un des thèmes les plus étudiés dans la recherche. L’industrie chimique n’aurait pu se développer à sa situation actuelle sur la base de la non- catalytiques, seules les réactions stœchiométriques. Environ 85 – 90% des produits de l’industrie sont fabriqués en des procédés catalytiques [5]. La catalyse améliore la vitesse et la sélectivité des réactions chimiques, ou permet la réalisation des réactions dans des conditions optimisées (température, pression, concentration …). De cette manière, des catalyseurs efficaces en combinaison avec des réacteurs optimisés et la conception totale de l’usine, sont le facteur clé de la réduction d’investissement. La mise au point de procédés de chimie fine est handicapée car elle nécessite des investissements importants pour une moindre production. Néanmoins les catalyseurs ont un rôle important à jouer pour remplacer certains procédés de chimie fine très polluants confrontés à des normes de plus en plus sévères. L’importance des catalyseurs sur notre société est non seulement basée sur son impact industriel et économique mais aussi sur son impact dans la production d’une très large gamme de produits de nos jours nécessaires et qui améliorent notre qualité de vie. C’est aussi une question d’un grand intérêt dans la maison que l’utilisation des réactifs et solvants toxiques et dangereux peuvent être évitées tandis que la formation de déchets ou sous-produits indésirables est minimisé. Souvent l’acte catalytique satisfait ces critères. Ainsi que des sources d’énergie alternatives ont vu un développement rapide par des procédés catalytiques, la protection de notre environnement est améliorée par des procédés basés sur la catalyse. Elle est devenue l’outil essentiel d’une chimie durable pour la production avec un minimum de déchets de molécules qui entrent dans tous nos produits de consommation. La catalyse intervient dans tous les procédés de conversion des ressources fossiles (pétrole, charbon, gaz naturel) vers de nouveaux vecteurs d’énergie comme l’hydrogène ou le méthanol utilisables dans des piles à combustible pour la production d’électricité. Elle trouve un nouveau champ d’application pour la production de biocarburants et de bioproduits à partir de ressources renouvelables. Elle est l’outil indispensable pour le traitement des gaz et particules toxiques émis dans l’atmosphère par les activités anthropogéniques. Elle participe de plus en plus à la dépollution et à recyclage des eaux industrielles, contribuant ainsi à la protection des milieux naturels. Enfin, elle s’invite dans des domaines inattendus, allant des appareils à usage domestique aux processus physiques et chimiques dans la haute atmosphère.
L’acte catalytique : description et analyse
Mécanisme d’action d’un catalyseur
Dans le cadre général, l’action des catalyseurs entre en fait de l’étude des mécanismes réactionnels, c’est-à-dire de la recherche des étapes successives par lesquelles les molécules des corps mis en réaction se transforment pour donner des produits finaux. Une réaction entre un ou plusieurs produits prend un certain temps. Il faut parfois quelques centièmes de seconde ou plusieurs jours. La présence du catalyseur modifie le mécanisme réactionnel et ouvre à la transformation une voie souvent plus complexe mais finalement plus rapide, comportant des étapes à faible énergie d’activation. La vitesse d’une réaction dépend de la fréquence des collisions éfficaces entre les réactifs (Loi d’Arrhénius) : (I.1) est l’énergie d’activation de la réaction (énergie cinétique minimale pour que la collision entre les réactifs soit éfficace) et est un facteur rendant compte de la fréquence des collisions et des exigences quant à l’orientation des molécules les unes par rapport aux autres pour qu’elles réagissent. Lorsqu’on procède à une réaction via la voie catalysée, la vitesse de la réaction augmente car l’énergie d’activation diminuée et le facteur pré- exponentiel diminué également. En effet, la probabilité de rencontre entre les espèces adsorbées est plus faible que la probabilité de rencontre entre les réactifs au sein du fluide (gaz ou liquide). Aussi, pour compenser cette diminution de A (divisé environ par 1012), est-il nécessaire d’abaisser l’énergie d’activation d’au moins 65 kJ mol-1 . D’une manière générale, une réaction catalysée possède une énergie d’activation environ 100 kJ mol-1 inférieure à l’énergie d’activation de la réaction non catalysée [1]. En plus, le catalyseur ne modifie pas la différence d’enthalpie libre entre les produits et les réactifs de la réaction considérée mais permet d’opérer la réaction selon un mécanisme différent. Les états initiaux et finaux sont inchangés, mais ce deuxième chemin réactionnel est énergétiquement plus favorable que celui de la réaction non catalysée. Pour ce faire, la réaction évolue via des intermédiaires d’un type différent des complexes activés habituellement rencontrés : ce sont des espèces dites adsorbées, résultant de l’adsorption des réactifs à la surface du catalyseur (Figure. I. 1). Figure. I. 1. Evolution de l’énergie potentielle d’un système réactionnel
Généralité Et Revue Bibliographique
Description qualitative de l’acte catalytique
La réaction catalysée en globe passe par de cinq étapes consécutives (Figure. I. 2) physiques et chimiques, ces étapes sont les suivantes [3, 6]: 1. La diffusion des réactifs vers la surface active du solide. 2. L’adsorption des réactifs sur le catalyseur. 3. La transformation chimique des espèces adsorbées. 4. La désorption des produits de la surface du catalyseur. 5. La diffusion des produits quittant la surface vers le fluide. Les étapes 1 et 5 correspondent à des processus physiques de transferts de matière vers les grains de catalyseur et à l’intérieur de ces grains pour les grains poreux. Sur laquelle se déroule la réaction, il faut que les réactifs puissent atteindre rapidement la surface active et que les produits puissent également s’en éloigner rapidement pour que cette surface, soit constamment alimentée pour être utilisée au maximum potentialité .Ce déplacement des molécules de la phase fluide vers la surface catalytique est régi par les lois de la diffusion (loi de Fick). La loi de Fick permet de calculer le flux des molécules de réactif, c’est-à-dire le nombre de molécules de réactif qui échoueront sur la surface active par centimètre carré et par seconde. Les étapes 2, 3, et 4 correspondent à des phénomènes chimiques dont l’ensemble constitue la transformation chimique proprement dite. Le processus d’adsorption et son processus inverse, la désorption, sont à la base des réactions catalysées par les solides prévenus au voisinage de la surface catalytique, les réactifs sont adsorbés, c’est-à-dire qu’ils réagissent avec la surface catalytique pour donner naissance à de nouvelles espèces chimiques plus réactives ; ces espèces adsorbées réagiront entre elles suivant un processus réactionnel énergétiquement plus favorable que celui impliqué dans le cas d’une simple activation thermique.
INTRODUCTION |