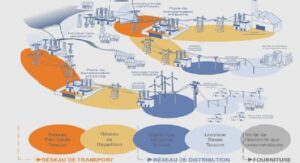
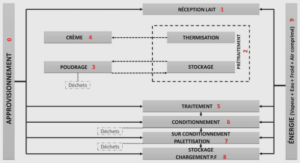
Techniques d’identification et de quantification des bactéries
Une série de 216 prélèvements de l’eau de mer est effectuée mensuellement d’Avril 2004 à Mai 2005 pour les 16 stations des principales plages d’Annaba réparties d’Est en Ouest et de Décembre à Mai 2005 pour les 4 stations des ports de commerce et de pêche.
Ces prélèvements ont été analysés au laboratoire de SEMP (service d’épidémiologie et de médecine préventive) du Centre de Santé – C.H.U. d’Annaba, pour identifier et quantifier: Les coliformes totaux. Les coliformes fécaux. Les streptocoques fécaux.
Les échantillons sont recueillis dans des flacons en verre de 250 ml soumis au préalable à un nettoyage rigoureux (un rinçage à l’eau potable puis à l’eau distillée) sèches, bouchés et stérilisés à 170 °C (au four Pasteur). Pour les eaux de baignade, les prélèvements sont effectués au moins à 2 m du rivage. Le flacon de prélèvement est tenu de sa base, le goulot vers le bas, enfoncé à -50 cm environ au dessous de la surface de l’eau puis ouvert. Il est tourné pour le redresser légèrement, l’orifice face au courent éventuel. Une fois le prélèvement effectué, le flacon est bouché, étiqueté et placé dans une glacière à l’abri de la lumière et à une température comprise entre 4 et 6 °C (Recommandations préconisées par l’O.M.S. / PNUE, pour la surveillance des eaux côtières). L’analyse au laboratoire est réalisée 6 à 8 heures après le prélèvement de l’échantillon . Tous les prélèvements sont accompagnés d’une fiche de renseignements sur laquelle on note : le lieu de prélèvement. la date et heure de prélèvement. l’état de la mer. la direction du vent
Milieux de cultures pour rechercher les streptocoques totaux
Bouillon à l’acide de sodium (bouillon de Rothe) D/C et S/C. Bouillon à Méthyl violet et azide de sodium (EVA) D/C et S/C.
Les streptocoques sont généralement pris globalement en compte comme des témoins de pollution fécale car tous, ont un habitat fécal: cependant, leur spécificité ne sciait pas identique pour toutes les espèces. Comme pour les coliformes totaux, la recherche des streptocoques fécaux comporte deux phases de tests; l’une présomptive et l’autre confirmative
La recherche des coliformes comporte 2 phases de test l’une est représentée par le test présomptif et l’autre par le test confirmatif.
Test présomptif: Pour ce test nous utilisant le milieu Rothe D/C et S/C. Par souci d’économie du milieu, nous avons travaillé avec une série de 3 tubes. Nous avons ensemencé : Trois tubes de Rothe à D/C avec 100 ml de l’échantillon. Trois tubes de Rothe à S/C avec l ml de l’échantillon. Trois tubes de Rothe à S/C avec 0,1 ml de l’échantillon.
Les tubes sont agités pour une homogénéisation. La lecture se fait après 48h d’inoculation dans une étuve à 37 °C. Tous les tubes présentant un louche microbien sont considérés comme pouvant contenant des Streptocoques fécaux et ils sont obligatoirement soumis au test confirmatif. Nous avons noté le nombre de tubes positifs dans chaque série.
Test confirmatif. Après agitation, à partir de chaque milieu de Rothe positif, nous avons ensemencé 5 à 6 gouttes dans un tube de bouillon Eva.
Après incubation de 24h dans une étuve à 37 °C, tous les tubes présentant une culture et un jaunissement, sont considérés comme positifs. Nous avons noté le nombre de tubes positifs dans chaque série et nous nous sommes reportées aux tables du NPP pour obtenir le nombre de Streptocoques fécaux présents dans 100 ml d’échantillon.
Les Coliformes totaux
Durant la période d’étude, de décembre 2004 à mai 2005, la variation mensuelle des CT est très significative. En avril et mai, le nombre des CT pour le site S7 (port de pêche), est compris entre la valeur guide (500 CT/100ml) et la valeur limite (10000 CT/100 ml) pour une valeur maximale de 2400 CT/100ml. Il en est de même pour le site S6 (port de pêche) en mai avec un minimum inférieur à 3 CT/100ml et pour le site S4 (port de commercial) entre décembre et janvier. Cependant, durant tout le cycle de l’étude, les valeurs enregistrées restent en dessous de la valeur guide sauf pour le site S5 en mai et le site S6 en avril avec 1100 CT/100ml.
La fig. 25 montre que la variation temporelle du nombre moyen des Coliformes totaux pour les sites considérés est très significative, avec une valeur maximale de 2400 CT/100ml pour le port de pêche en mai, cette valeur étant comprise entre la valeur guide et la valeur limite et une valeur minimale de 3.5 CT/100ml en décembre pour le même site.
Durant toute la période d’étude à l’exception de mai pour le port commercial et avril pour le port de pêche les valeurs enregistrées sont au delà de la valeur guide.
Pollution par les métaux lourds
Les prélèvements des sédiments superficiels ont été réalisés mensuellement entre février 2005 et ont concernées les stations 2, 3, 4, 7, 10, 15 et 20. Dix métaux lourds ont été retenus il s’agit de l’arsenic, le cadmium, le cuivre, le chrome, le mercure, le plomb, le zinc, le fer, le manganèse et le nickel.
Les métaux lourds pour désigner les oligoéléments et les toxiques minéraux indispensables au développement des êtres vivants quand ils sont en très faibles quantités mais, à plus fortes concentrations deviennent toxiques. La plupart sont désignés comme métaux lourds, bien que tous ne soient pas des métaux si on se réfère à la classification périodique des éléments. Ces derniers sont soumis à des normes strictes particulièrement dans l’eau potable et dans les rejets industriels. Les analyses par S.A.A. ont été mises en œuvre sur la totalité des échantillons de sédiments préalablement soumis à une hydrolyse acide pour libérer les métaux lourds susceptibles d’y être présents sous forme de dérivés conjugués.
Table des matières
1. Introduction
2. Matériels et méthodes
2.1. Localisation G.P.S. des stations d’étude
2.1.1. Secteur de la Commune d’El Bouni
2.1.1.1. Concernant la station 1
2.1.1.2. Concernant la station 2
2.1.1.3. Concernant la station 3
2.1.2. Secteur de la Commune de Annaba
2.1.2.1. Concernant les stations 4 et 5
2.1.3.2. Concernant les stations 6 et 7
2.1.2.3. Concernant les stations 8 et 9
2.1.2.4. Concernant les stations 10 et 11
2.1.2.5. Concernant les stations 12 et 13
2.1.2.6. Concernant les stations 14 et 15
2.1.2.7. Concernant les stations 16 et 17
2.1.2.8. Concernant la station 18
2.1.2.9. Concernant la station 19
2.1.2.10. Concernant la station 20
2.2. Etude expérimentale
2.2.1. Chronologie et technique de mesure des paramètres physico-chimiques
2.2.2. Techniques d’identification et de quantification des bactéries
2. 2. 2. 1. Techniques d’analyse
2.2.2.2. Appareillages utilisés
2.2.2.3. Milieux de cultures pour la recherche des coliformes
2.2.2.3.1. Test présomptif
2.2.2.3.2. Test confirmatif
2.2.2.4. Milieux de cultures pour rechercher les streptocoques totaux
2.2.2.4.1. Test présomptif
2.2.2.4.2. Test confirmatif
2.2.2.5. Expression des résultats
2.2.2.7. Indice de Bourgeois
2.2.3. Techniques d’identification et de quantification hydrocarbures totaux
2.2.3.1. Sites et méthode d’échantillonnage
2.2.3.2. Principe de la méthode
2.2.3.3. Matériels utilisés
2.2.3.4. Mode opératoire
2.2.3.4.1. Extraction de l’eau de mer
2.2.3.4.2. Technique de mesure
2.2.3.4.3. Expression des résultats
2.2.4. Techniques d’identification et de quantification des métaux lourds
2.2.4.1. Sites et technique d’échantillonnage
2.2.4.2. Analyse des échantillons
2.2.4.2.1. Principe de la méthode
2.2.4.2.2. Appareillages et réactifs utilisés
2.2.4.2.3. Mode opératoire
2.3. Normes de qualité utilisées
3. Résultats
3.1. Positionnement G.P. S. des stations d’étude
3.2. Résultats des paramètres physico chimiques
3.2.1. Concernant les plages S1, 2, 3, 8 jusqu’à 20
3.2.1.1. La Température
3.2.1.2. La Salinité
3.2.1.3. Le pH
3.2.1.4. L’Oxygène dissous
3.2.2. Concernant les ports de S4 à S7
3.2.2.1. La Température
3.2.2.2. La Salinité
3.2.2.3. Le pH de l’eau
3.2.2.4. Oxygène dissous
3.3.2.5. Résultats cumulatifs
3.3. Résultats de l’analyse bactériologique
3.3.1. Concernant les plages S1, 2, 3, 8 jusqu’à 20
3.3.1.1. Les Coliformes totaux
3.3.1.2. Les Coliformes fécaux
3.3.1.3. Les Streptocoques fécaux
3.3.1.4. Résultats cumulatifs
3.3.1.5. L’indice de Bourgeois (1980) dans les plages d’Annaba
3.3.2. Concernant les ports de S4 à S7
3.3.2.1. Les Coliformes totaux
3.3.2.2. Les Coliformes fécaux
3.3.2.3. Les Streptocoques fécaux
3.3.2.4. Résultats cumulatifs
3.3.2.5. L’indice de Bourgeois (1980) des ports d’Annaba
3. 4. Polluants par les hydrocarbures totaux (HCT)
3.4.1. Concernant la S2 (Embouchure Oued Seybouse)
3.4.2. Concernant la S3 (Asmidal)
3.4.3. Concernant la S4 (Port Commercial)
3.4.4. Concernant la S7 (Port de Pêche)
3.4.5. Concernant la S8 (Rezgui Rachid)
3.4.6. Concernant la S11 (Rizi Amor)
3.4.7. Concernant la S15 (Refes Zahouen)
3.4.8. Concernant la S20 (Ain Achir)
3.4. 9. Résultats cumulatifs de la pollution par les hydrocarbures totaux (HCT)
3. 5. Pollution par les métaux lourds
3.5.1. Résultats des quantifications de l’arsenic
3.5.2. Résultats des quantifications du cadmium
3.5.3. Résultats des quantifications du cuivre
3.5.4. Résultats des quantifications du chrome
3.5.5. Résultats des quantifications du mercure
3.5.6. Résultats des quantifications du plomb
3.5.7. Résultats des quantifications du zinc
3.5.8. Résultats des quantifications du fer
3.5.9. Résultats des quantifications du manganèse
3.5.10. Résultats des quantifications du nickel
3.5.11. Normes et classes de pollution par le calcul de l’indice de contamination
4. Discussion et conclusion
5. Références bibliographiques
Annexes