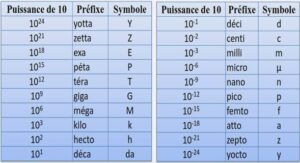
Comportement à la corrosion généralisée de l’acier doux C15 en milieu béton avec et sans
bioadjuvant
Influence de la composition de la solution interstitielle de bétons sur le comportement électrochimique de l’acier doux C15
Evolution du potentiel libre de corrosion en fonction du temps d’immersion et du milieu d’étude L’évolution du potentiel de corrosion en fonction du temps d’immersion dans les solutions synthétiques représentatives de la solution interstitielle de béton a été suivie pendant une soixantaine d’heures (comme cela a été expliqué précédemment dans le chapitre II, le temps d’immersion pour toutes les solutions d’étude a été fixé à 60 heures afin d’atteindre un état stationnaire). L’évolution du potentiel libre de corrosion en fonction du temps d’immersion est présenté figure IV.1. Figure IV.1 : Evolution du potentiel de corrosion de l’acier doux C15 en fonction du temps d’immersion dans les différentes solutions synthétiques représentatives de la solution interstitielle de béton à base de ciment CEM I, II et III. 150 L’acier doux voit son potentiel augmenter en fonction du temps d’immersion. Cette variation du potentiel traduit la modification de l’interface acier / solution et signifie que l’acier est protégé par la formation d’une couche qui comporte les produits d’oxydation du métal ayant réagi chimiquement avec les constituants du milieu. Pour les trois solutions, et après quelques minutes d’immersion, la valeur du potentiel libre de corrosion est très cathodique et de l’ordre de -0,90 ± 0,07 V/ESS. Ce potentiel augmente progressivement avec le temps d’immersion, et sa valeur finale est différente d’une solution à une autre. Cette différence de la valeur de Ecorr peut être corrélée à la différence de composition des solutions interstitielles. En effet il a été montré par Abd El Haleem et al. [9] que le potentiel de corrosion mesuré pour une électrode d’acier doux immergée dans une solution saturée d’hydroxyde de calcium (solution simulant l’environnement basique de l’armature dans le béton), diminue de façon considérable en présence de sulfates. Ainsi, plus la concentration en ions sulfate augmente, plus la valeur du potentiel libre en fonction du temps d’immersion est cathodique. Au-delà d’une concentration critique de sulfates ce potentiel diminue traduisant une rupture de la couche d’oxydes normalement formée après immersion, induisant ainsi le début de corrosion par piqûres. Dans notre cas, pour la solution CEM I contenant une concentration de sulfate de [SO4 2-] = 190 mmol/l, Ecorr augmente en fonction du temps et semble atteindre une valeur stationnaire au bout d’une soixantaine d’heures d’immersion. Néanmoins sa valeur est de l’ordre de -0,85 V/ESS, ce qui est trop faible pour la situer dans le domaine passif comme l’indique la courbe de polarisation anodique tracée dans la solution de référence et présentée dans le chapitre III et qui montre que le domaine passif commence pour E > -0,65 V/ESS. Selon Evans, [11] la couche d’oxydes formée dans de telles conditions ne fournit pas la passivité requise pour la protection de l’armature contre la corrosion. Pour la solution CEM II contenant [SO4 2-] = 120 mmol/l, la valeur finale de Ecorr est plus anodique, et la variation entre la valeur initiale et la valeur finale du potentiel est beaucoup plus prononcée que celle observée pour la solution CEM I. Finalement et pour la solution CEM III contenant seulement 80 mmol/l de sulfate, la valeur du potentiel est la plus anodique et égale à -0,65V/ESS, permettant ainsi la formation d’une couche d’oxydes protectrice sur la surface de l’acier. Ces résultats sont en accord avec ceux obtenus par Abd el Haleem et al.[9] qui ont montré que le potentiel libre de corrosion devient plus cathodique 151 lorsque la concentration en sulfates augmente, mettant ainsi en évidence l’effet agressif non négligeable de cette espèce. De plus, il a été montré que lorsque la concentration en sulfates est importante, la couche d’oxydes est poreuse et faiblement protectrice [12,13].
Courbes de polarisation stationnaire anodiques
Des courbes de polarisation anodiques ont été tracées dans les différentes solutions interstitielles synthétiques après 60 heures d’immersion à Ecorr. Ces courbes sont présentées sur la figure IV.II et sont comparées à celle obtenue dans la solution de référence NaOH 0,1 M déjà présentée dans le chapitre III. Figure IV.2 : Courbes de polarisation anodiques stationnaires de l’acier C15 tracées après 60 h d’immersion à Ecorr dans les différentes solutions interstitielles synthétiques et dans la solution NaOH 0,1 M. Courbes tracées point par point. Vitesse de rotation de l’EDT : 0 tr/min. Le pH est ajusté à 13 avant chaque expérience. L’allure de toutes les courbes de polarisation est similaire : elles présentent un palier passif étendu sur plusieurs centaines de mV, mais il faut remarquer que la valeur du courant passif est fonction de la composition de la solution utilisée (tableau IV.1). Ce palier passif est suivi d’une augmentation du courant correspondant au domaine transpassif pour des potentiels E > 0,1 V/ESS. Comme expliqué précédemment, le potentiel de corrosion est fonction de la concentration en sulfates (tableau IV.1) et diminuent quand la concentration en sulfates Tableau IV.1: Potentiel de corrosion Ecorr après 60 h d’immersion et densité de courant passif stationnaire jstat dans NaOH 0,1 M et dans les différentes solutions interstitielles synthétiques. En effet, jstat est 15 fois plus élevée dans la solution CEM I que dans la solution CEM III. Un classement du pouvoir passivant des différentes solutions peut être ainsi obtenu à partir des courbes de polarisation : CEM I < CEM II < CEM III ≤ NaOH. Ces résultats sont en accord avec ceux obtenus par T. Haruna et al. [14]. Étant donné que le pH des différentes solutions est identique et égal à 13, l’ensemble de ces résultats permet de conclure que le pH n’est pas le seul paramètre déterminant le comportement électrochimique de l’acier : à pH constant, jcorr et Ecorr dépendent également de la composition de la solution utilisée. Ces résultats sont en accord avec ceux déjà présentés par Abd El Haleem et al. [9,15], Ghods et al. [10] et Gui et Devine [16] qui ont mis en évidence l’effet néfaste des ions SO4 2- sur le comportement à la corrosion d’un acier doux et, en particulier, la diminution du potentiel de corrosion et l’augmentation du courant passif accompagnant l’enrichissement du milieu en sulfates. En effet, dans un milieu alcalin contenant des ions sulfate, une compétition s’établit entre la croissance / cicatrisation du film d’oxydes par les ions OHet sa destruction par les ions agressifs SO4 2-. Lorsque la concentration en sulfates est suffisamment élevée, le processus de destruction de la couche d’oxydes prédomine, pouvant ainsi induire la corrosion par piqûres du matériau. Montemor et al. [17] quant à eux ont mis en évidence, par des analyses de surface XPS, l’influence de la composition chimique de la solution interstitielle sur la capacité protectrice du film d’oxydes. Ainsi la présence de sulfates dans la solution interstitielle conduit à la formation d’un film passif riche en eau et formé majoritairement d’oxyhydroxide (FeOOH), en accord avec les résultats de Al-Tayyib et al. [18] qui ont conclu 153 que la corrosion de l’acier dans le béton en présence de sulfates est induite par la modification de la couche d’oxydes protectrice. Dans notre cas et afin de confirmer la relation entre le pouvoir passivant de chaque solution et la quantité de sulfates qu’elle contient, trois solutions composées de NaOH et de concentrations en sulfates croissantes ont été testées. Le pH de ces différentes solutions a été systématiquement ajusté à 13 afin de s’affranchir de l’influence de ce paramètre. Les courbes anodiques stationnaires sont présentées sur la figure VI.3. Les différentes courbes présentent la même allure, et ce même en présence de différentes concentrations en sulfates. Une légère diminution du potentiel de corrosion ainsi que de la densité de courant passif en fonction de la concentration en sulfates est à noter. Les valeurs de ces deux paramètres sont reportées dans le tableau IV.2