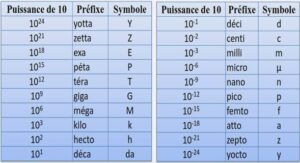
L’ALUMINIUM
L’aluminium du latin « alumen », qui signifie léger, est le métal le plus répandu sur la terre, il constitue 8% de l’écorce terrestre étant par ordre d’abondance le troisième élément de la nature après l’oxygène et le silicium (Chappuis, 1991; Kintz, 1998). On ne l’y trouve cependant pas à l’état libre mais combiné à d’autres éléments sous forme des sels et d’oxydes. Les composés les plus fréquents sont les alumines et les hydroxydes provenant essentiellement de la bauxite, les silicates provenant de l’argile et des micas, et des formes hydrosolubles complexées aux sulfates « alum », nitrates, chlorures en présence de matières organiques dissoutes. Ces derniers sont produits industriellement par différents réactions chimiques (Bounias, 1999; Vargel, 1999). Sulfate d’aluminium Al2(SO4)3: formé par la combinaison de l’acide sulfurique (H2SO4) et l’hydroxyde d’aluminium [Al(OH)3]. Il est disponible sous différentes formes solides. 3 H2SO4 + 2 Al(OH)3 Al2(SO4)3 + 6 H2O Nitrate d’aluminium Al(NO3)3: est un sel de l’acide nitrique et de l’aluminium qui peut être prépare par action de l’acide nitrique sur le métal ou bien par action de l’acide nitrique sur le trioxyde de dialuminium. Il existe sous forme d’un hydrate cristallin. Al2O3 + 6 HNO3 2 Al(NO3)3 + 3 H2O Chlorure d’aluminium AlCl3: produit suit à une réaction directe entre les éléments aluminium et le chlore ou bien l’acide chlorhydrique. Il existe sous forme d’un hydrate cristallin. 2 Al + 3 Cl2 2 AlCl3 2 Al + 6 HCl 2 AlCl3+ 3 H2 L’aluminium est un élément non essentiel pour l’homme. Contrairement, il est un composant fondamental des roches, du sol et des eaux souterraines. L’acidité facilite la dissolution, la mobilisation ainsi que l’absorption de l’aluminium (Bounias, 1999; Dorey, 2008).
Propriétés physicochimiques
L’aluminium est un métal léger gris argenté brillant, n’a pas d’odeur ni de saveur, qui présente des propriétés physicochimiques particulièrement importantes. Son symbole chimique est Al portant le numéro 13 dans la classification périodique des éléments (avec 27 protons et neutrons, 13 électrons répartie sur 3 orbites avec 3 électrons de valence) il n’a pas d’isotopes. C’est un métal de faible densité 2,7 g/cm3 , avec une masse atomique de 27 g/mol, son point de fusion est de 660°C et son point d’ébullition est de 2467 0C (Kintz, 1998; Vargel, 1999). Il s’agit d’un métal amphotère qui réagit avec les acides et les bases formant ainsi des sels stables à pH≤3 et des aluminates à pH≥11. Il est quasiment soluble en milieu acide, cette solubilité diminuée avec l’augmentation du pH, il est totalement insoluble à pH neutre (Chappuis, 1991; Vargel, 1999).
Effets toxiques de l’aluminium
La dose létale (DL50) de l’Al varie de 0,14 à 6,20 g d’Al/Kg du poids corporel, ses effets toxiques relèvent essentiellement d’exposition chroniques contrairement à sa toxicité aiguë qu’est très faible (Gourier-fréry et fréry, 2004). Les effets de l’intoxication aluminique sont principalement observés au niveau du système nerveux, du système osseux et du système sanguin (Kintz, 1998; Dorey, 2008).
Effets hématologiques
L’aluminium agit en compétition avec le fer sur les sites de fixation à la transferrine inhibant ainsi la synthèse de l’hémoglobine. Aussi il perturbe l’érythropoïèse par action direct, en diminuant la durée de vie des érythrocytes et d’hématocrite avec attente de la lignée rouge (microcyte et hémoglobine) ce qui provoque l’apparition d’une anémie microcytaire hypochrome. De plus, l’Al empêche les plaquettes sanguines de s’agglomérer pour former le caillot et augmentant ainsi le temps de saignement. Ces effets sont réversibles à l’arrêt de l’exposition et lors de traitement par les chélateurs de l’aluminium (Gourier-fréry et fréry, 2004; Mailloux et al., 2011)
Effets osseux
L’aluminium est susceptible d’entrainer une déminéralisation osseuse suite à une déplétion phosphorée accompagnée d’une perturbation métabolique de la vitamine D3 (Chappuis, 1991; Kintz, 1998). De plus l’intoxication aluminique est caractérisée par: La présence des dépôts aluminiques le long du front de minéralisation. Une réduction de la vitesse de calcification et une augmentation de l’épaisseur des travées ostéoïdes (Dorey, 2008). Synthèse bibliographique Les mécanismes d’actions évoqués pour illustrer l’impact de l’Al dans toutes ces perturbations semblent faire intervenir à la fois: Des effets aluminiques directs Formation des sels basiques insolubles entre l’Al et le phosphate dans le tube digestive ce qui entrainent une augmentation de l’excrétion fécale du phosphate et par conséquent diminution de son excrétion urinaire, ainsi que son absorption intestinale provoquant une hypophosphatémie. L’Al agit sur le squelette en réduisant fortement la formation de l’os, activant la déminéralisation osseuse et produisant ainsi une ostéomalacie résistante au traitement par la vitamine D ou ses métabolites. Elle s’exprime le plus souvent par des douleurs et des arthralgies, puis surviennent des fractures osseuses spontanées, des déformations osseuses sévères et une myopathie des muscles proximaux qui peut devenir invalidante. L’Al constitué un obstacle à l’incorporation de calcium dans l’hydroxyapatite (Chappuis, 1991; Bounias, 1999; Larwerys et Lison, 2007). Des effets aluminiques indirects L’aluminium réagir par interférence avec la parathormone (Gourier-fréry et fréry, 2004). 3.3. Effets neurologiques Les cellules nerveuses présentent une sensibilité particulière à l’Al (Berthon, 2002; Dorey, 2008). Il est donc reconnu comme un facteur neurotoxique responsable de différentes maladies neurodégénératives entre autres: L’encéphalopathie: considérée comme l’une des premières manifestations révélatrices de la toxicité aluminique. L’encéphalopathie associée dans une première phase des troubles de la parole et de l’écriture avec lenteur de l’élocution, dystonie et dyspraxie, puis apparaissent des trémulations, des myoclonies diffuse, une myofasciite a macrophage, une dyspraxie des mouvements de type cérébelleux, l’épilepsie et troubles de la mémoire ainsi que de la concentration et des troubles psychiatriques (trouble de la personnalité, dépression, troubles paranoïdes, hallucination, des épisodes confusionnelles avec perte de la conscience pouvant conduire au décès) (Chappuis, 1991; Kintz, 1998; Gourier-fréry et fréry, 2004). L’Alzheimer: se caractérise par une dégénérescence neurofibrillaire (présence d’agrégat constitués de paires hélicoïdales de filaments appariés) (Bounias, 1999; Berthon, 2002). Synthèse bibliographique 4 Troubles des fonctions psychomotrices: ont été également mis en évidence, manifestant principalement par des troubles de l’humeur à type d’irritabilité et de fatigue avec troubles de l’attention, des troubles de la motricité (coordination motrice), de la mémoire et de l’organisation visuospatiale (perturbation des tests visuels) (Gourier-fréry et fréry, 2004; Larwerys et Lison, 2007). Changement histopathologique: dans le cerveau caractériser par une vacuolisation cytoplasmique et/ou nucléaire avec dégénérescence neuronale (Berthon, 2002; Larwerys et Lison, 2007). En effet, différents mécanismes sont évoqués pour expliquer la neurotoxicité de l’Al: Mode d’action direct Provoque la dégénérescence neurofibrilaire par modification des protéines du cytosquelette des neurones avec formations, accumulation et agrégation d’âmes insolubles de la protéine β-amyloïde, de la protéine tau et d’autres protéines neurofibrilaires (Larwerys et Lison, 2007). Provoque la dégénérescence des astrocytes ce qui accélère la mort de tissus nerveux qu’ils nourrissent. De plus, l’Al agit en suscitant l’apoptose (les cellules nobles du cerveau, les neurones réagissent très rapidement a l’apoptose) (Larwerys et Lison, 2007). Perturbe la communication intercellulaire entre les cellules gliales notamment les astrocytes ce qui entraine un déséquilibre de l’homéostasie (échange d’ions et de certain métabolites, recaptage des neurotransmetteurs ainsi que le passage des hormones) nécessaire au bon fonctionnement du système nerveux (Berthon, 2002). Mode d’action indirect: l’Al agit sur l’activité des différents enzymes neurocellulaires: Inhibition de l’acétylcholinestérase de façon non compétitive, entrainerait des perturbations de la neurotransmission cholinergique (Chappuis, 1991; Larwerys et Lison, 2007). Inhibition de l’activité héxokinase et la glucose-6-phosphate déshydrogénase dans le cerveau suite à une combinaison entre l’Al et ATP (Chappuis, 1991). Inhibition du transport de la L-glutamine et de l’acide γ-aminobutyrique (GABA) ainsi que d’autres amines neurotransmettrices des synaptosomes suite à une interférence avec la Na+K +ATPase et la Ca2+Mg2+ATPase aboutissant donc à l’altération des phénomènes de captation et largage de ces acides aminés neurotransmittrices et autres neurotransmetteurs par la membrane neuronale présynaptique. Ce qui entraîne leurs accumulations dans certain région du cerveau (Larwerys et Lison, 2007). Synthèse bibliographique 5 Inhibition de la dihydroptéridine réductase entrainant une chute de la concentration en tétrahydrobioptérine et par voie de conséquence de la tyrosine et des neurotransmetteurs au niveau du cerveau (Chappuis, 1991; Berthon, 2002). Inhibition des enzymes de réplication nucléaire entrainant une inhibition de la transcription de l’ADN en ARN suite à une fixation facultative de l’Al sur l’ADN (Larverys et Lison, 2007; Dorey, 2008). Perturbation de l’homéostasie calcique intracellulaire suite à l’interférence au niveau de la Ca2+ATPase enzyme majeur dans l’extrusion du calcium. La perturbation des systèmes de régulation du Ca2+ intercellulaire peut causer des lésions neuronales irréversibles (Berthon, 2002). Changement dans la perméabilité de la barrière hémato-encéphalique (BHE): augmentation de la perméabilité au sucrose, à la thyroxine, au cortisol, à la prolactine, à l’hormone de croissance et à l’hormone lutéinisante (Chappuis, 1991; Berthon, 2002).
Autres effets
L’Al provoque une fibrose (ou aluminose) voire une granulomatose accompagnée d’une alvéolite à lymphocytes T auxiliaires similaire à la bérylliose en cas d’exposition massive. Une protéinase alvéolaire, une pneumonie interstitielle chronique une symptomatologie d’asthme et d’hyperréactivité bronchique de type irritatif (connue de longue date sous le non de « potroom asthma »). Ces effets sont observés suite à une irritation direct du système respiratoire par le métal (Kintz, 1998; Gourier-fréry et fréry, 2004; Dorey, 2008). D’autre part, l’Al a une influence sur la motilité par inhibition des contractions intestinales (induit par l’acétylcholine) induisant ainsi des cas de constipation (Bounias, 1999; Dorey, 2008). De plus, l’Al interfère avec le métabolisme de certains acides aminés présents dans le sang et provoque des changements structuraux des lipoprotéines. Aussi, il perturbe le métabolisme des graisses et favorise l’obésité (Berthon, 2002; Fxley, 2003). 4. Aluminium et stress oxydatif Dans les organismes vivant l’Al provoque un état du stress oxydatif par la production des radicaux libres. En effet, suite de sa liaison aux groupes phosphates des phospholipides, l’aluminium favorise la désorganisation et la discontinuité de la membrane plasmique favorisant ainsi le passage de certaines espèces chimiques telle que les ions métalliques (Fe+2 par exemple) qui peuvent initier le processus radicalaire par le biais de la réaction de Fenton. Synthèse bibliographique 6 Les radicaux formés réagissent avec tous les composés cellulaires (lipides, protéines, ADN) modifiant leurs structures et leurs fonctions biologiques. De plus, l’aluminium inhibe l’activité de plusieurs enzymes antioxydantes, il peut même diminuer le taux du GSH (Berthon, 2002; Fxley, 2003). 5. Toxicocinétique 5.1. Exposition A l’exception des cas d’exposition pulmonaire dans un contexte professionnel, l’exposition à l’Al est essentiellement alimentaire (les additifs alimentaires comme les colorants, les antiagglomérants, les affermissants, les épaississants, les stabilisants ou correcteur d’acidité…) et médicamenteuse (les médicaments antiacides, les pansements gastro-intestinaux, les vaccins, les liquides de dialyse et la nutrition parentérale prolongée, ainsi que des céramiques et ciments à base d’Al pour des implants en dentisterie, chirurgie maxillo-faciale et orthopédique). De plus, l’utilisation de l’Al dans la fabrication d’un grand nombre de produits cosmétiques, constitue également une source d’exposition (Figure 1) (Bounias, 1999; Gourier-fréry et fréry, 2004; Mailloux et al., 2011). 5.2. Absorption L’Al peut pénétrer dans l’organisme humain par voie respiratoire, par la peau et les muqueuses, par voie digestive et par voie parentéral. Quelle que soit la voie de contact l’Al est très faiblement absorbé. L’absorption s’effectuerait essentiellement au niveau du tractus digestif. Le lieu d’absorption est différent selon les auteurs, selon Feinroth, (1982) elle s’effectuerait au niveau du jéjunum et de l’iléon, Alfrey, (1986) suggère que l’absorption se situerait essentiellement au niveau de l’estomac et du duodénum proximal. En revanche, de nombreux facteurs sont susceptibles d’influencer l’absorption et la rétention de l’Al. Elle dépend de la spéciation du composé (c’est à dire la forme chimique sous la quelle l’Al est présent dans le milieu: il est à noté, que la liaison de l’Al avec certains acides organiques « acide citrique… » augmente son absorption. Tandis que, la présence de phosphate, de fluorure et d’acide silicique diminue l’absorption d’Al, suite à la formation des complexes peu solubles), de la solubilité du composé dans le milieu biologique considéré, elle même dépendante du pH du milieu, ainsi que de la granulométrie du composé (le pourcentage d’Al qui passe dans le sang diminue si la dose ingérée augmente) (Suntherland et Greger, 1998; Berthon, 2002).