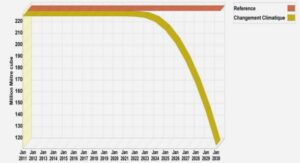
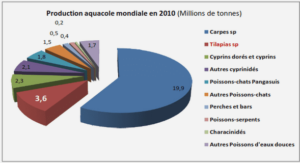
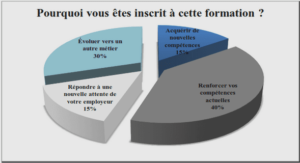
Applications microfluidiques en protéomique
Ces dernières années, la rapidité et la sensibilité des appareils en MS ont fortement progressé. La nanoLC, caractérisée par l’utilisation de colonnes plus longues avec des particules de plus petite taille, s’est développée dans le même temps. La combinaison de ces avancées a permis une meilleure couverture du protéome. L’ajout d’un mode de fractionnement à pH basique (High pH Reversed phase) permet, avec 50 fractions, d’identifier jusqu’à 8400 protéines à partir 100 µg d’échantillon70. Cependant, pour mieux étudier l’hétérogénéité cellulaire, il est nécessaire de travailler avec moins d’échantillon. Pour cela, les protocoles d’analyse doivent être plus intégrés pour gagner en sensibilité. La miniaturisation, avec sa capacité d’intégrer plusieurs réactions chimique et biochimique dans un petit volume, est une piste sérieuse pour la réduction de la consommation en échantillon. L’application de la microfluidique à la protéomique a permis la publication de plusieurs dispositifs microfluidiques destinés à la miniaturisation de tout ou une partie d’un protocole d’analyse des protéines. La miniaturisation de l’approche bottom-up présente plus d’intérêt car elle est couramment utilisée mais aussi par ce qu’elle présente une étape de préparation d’échantillon plus longue. Le dispositif microfluidique idéal devrait permettre de miniaturiser complètement l’approche bottom-up de la culture cellulaire à l’injection des peptides en MS. Malgré tous les avantages qu’il offrirait, ce type de dispositif n’existe pas encore71. Cependant, différents dispositifs microfluidiques ont permis la miniaturisation de la lyse cellulaire, la purification des protéines, la digestion et la séparation. L’intégration de toutes ces dispositifs en un seul n’est pas encore réalisée.
Le dispositif microfluidique présenté à la Figure 13 devrait permettre de miniaturiser l’ensemble des étapes d’un protocole bottom-up. Il est inspiré des dispositifs microfluidiques publiés dans la littérature72,74,77 et ayant permis de miniaturiser une partie du protocole bottom-up. Une première chambre de réaction (3) permettrait de faire de la culture cellulaire ou d’exposer des cellules à des réactifs. Après la lyse cellulaire, les protéines seraient purifiées avec phase solide du type C4. Cette phase permettra aussi d’effectuer les réactions de réduction, d’alkylation et digestion des protéines. Les peptides issus de cette digestion vont ensuite être séparés sur une colonne C18 intégrée à la puce. Un TIP intégré à la puce permettra de coupler la micropuce directement au spectromètre de masse. La miniaturisation des différentes étapes est déjà réalisée mais leur association sur une même puce résulterait en une micropuce complexe. La première étape d’une étude protéomique est l’extraction des protéines à partir d’échantillons biologiques (cellules, tissu, fluides biologiques). L’extraction des protéines peut être réalisée par destruction de la membrane cytoplasmique par des méthodes chimique, mécanique, thermique ou optique. C’est une étape très importante car elle détermine la quantité réelle et la diversité des protéines analysées. Miniaturiser cette étape est donc d’une grande importance. Cependant, il n’est pas aisé de miniaturiser la lyse cellulaire dans un dispositif microfluidique. En effet, les débris libérés lors de la lyse cellulaire peuvent entrainer un colmatage.
La lyse chimique
c’est la plus simple méthode à mettre en œuvre dans les canaux microfluidiques. L’une des stratégies les plus simples consiste à piéger les cellules grâce à un réseau de piliers par exemple (Figure 14). Elles sont ensuite lysées en les mettant en contact avec une solution chimique adéquate. Cette stratégie a été mise en place par Hellmich et al. en utilisant une solution de SDS 5% pour la lyse cellulaire en 6 secondes72. Cette approche est avantageuse dans sa simplicité de mise en œuvre et sa rapidité. Cependant, elle demande une grande résolution pour la microfabrication d’un réseau de piliers capables de piéger une particule de la taille d’une cellule. L’utilisation d’un détergent comme le SDS n’étant pas compatible avec une détection par MS, une étape de purification est nécessaire avant l’analyse en MS. L’ajout d’un compartiment de purification rend la micropuce plus complexe. La lyse mécanique : la compression et la friction sont des actions mécaniques qui peuvent être utilisées pour la lyse cellulaire. Elles sont même nécessaires pour la lyse de certaines cellules comme les levures (Saccharomyces cerevisae). L’utilisation conventionnelle de billes de verre pour générer de la friction menant à la lyse cellulaire a été par ailleurs adaptée dans une plateforme microfluidique en forme de disque en utilisant des billes aimantées soumises à un champ magnétique et un mouvement de rotation (Figure 15). Ce système a permis l’extraction protéique de cellules de levure mais avec une efficacité qui ne représente cependant que 65% de celle de l’approche classique73. D’autres dispositifs microfluidiques mettent en œuvre des structures pointues pour percer les cellules ou encore des pièges pour lyser les cellules par compression74.